Mechanizmy galvanickej korózie, príklady, ochrana

- 4855
- 224
- Mgr. Pravoslav Mokroš
Ten Galvanická alebo elektrochemická korózia Je to proces, ktorým sa kov alebo zliatina degraduje viac závratne v porovnaní s jeho konvenčnou oxidáciou. Dá sa povedať, že ide o zrýchlenú oxidáciu a dokonca aj úmyselne LED; ako v batériách alebo batériách.
Toto sa deje za série podmienok. Po prvé, musí existovať aktívny kov, nazývaný anóda. Tiež a po druhé, musí existovať trochu reaktívneho šľachtického kovu zvaného katód. Tretia a štvrtá podmienka je prítomnosť média, kde sa šíria elektróny, ako je voda a iónové alebo elektrolytové druhy.
 Oxidovaná koruna. Zdroj: pixnio.
Oxidovaná koruna. Zdroj: pixnio. Galvanická korózia je pozorovateľná najmä v morských prostrediach alebo na brehoch pláží. Vzduchové prúdy zdvíhajú hmotnosti vodných pary, ktoré zase pretiahli niektoré ióny; Ten druhý končí priľnutím k tenkej vrstve vody alebo kvapiek, ktoré spočívajú na kovovom povrchu.
Tieto podmienky vlhkosti a slanosti uprednostňujú koróziu kovu. To znamená, že železná koruna, ako je tá, ktorá je v Superior Image.
Ľahkosť, ktorú bude kov musieť oxidovať v porovnaní s iným, sa dá kvantitatívne merať prostredníctvom svojich redukčných potenciálov; V knihách chémie sú s týmito potenciálmi a. Čím negatívnejšie, tým väčší je váš sklon k oxidácii.
Ak je tento kov v prítomnosti iného s veľmi pozitívnym redukčným potenciálom, a preto bude mať veľký AE, oxidácia reaktívneho kovu bude agresívnejšia. Dôležité sú aj ďalšie faktory, ako je pH, iónová sila, vlhkosť, prítomnosť kyslíka a vzťah medzi oblasťami oxidovaného kovom a tým, ktorý je znížený, sú tiež.
[TOC]
Mechanizmy
Koncepty a reakcie
Pred riešením mechanizmov za galvanickou koróziou sa musia objasniť určité koncepty.
Pri reakcii Rédox druh stratí elektróny (oxidované), zatiaľ čo iný ich vyhrá (je znížený). Elektróda, na ktorej sa oxidácia stane, sa nazýva anóda; A na ktorom k redukcii dochádza, katód Redcat zapamätať si).
Tak pre elektródu (jeden kus, skrutky atď.) kovu M, ak je oxidovaný, hovorí sa, že ide o anódu:
M => mn+ + nekóda-
Počet uvoľnených elektrónov sa bude rovnať veľkosti kladného zaťaženia katiónu mn+ výsledný.
Potom iná elektróda alebo kov (oba kovy musia byť nejakým spôsobom v kontakte), prijíma uvoľnené elektróny; To však netrpí chemickou reakciou, ak získajú elektróny, pretože by ich iba vykonávali (elektrický prúd).
Preto musí existovať iný druh v roztoku, ktorý tieto elektróny môžu formálne akceptovať; Napríklad ľahké znížiť kovové ióny:
Môže vám slúžiť: Nehomogénny systémRn+ + nekóda- => R
To znamená, že by sa vytvorila vrstva kovovej R a elektróda by sa stala ťažšou; zatiaľ čo kov M by stratil hmotu, pretože ich atómy sa rozpúšťajú.
Depolarizátory
A ak neexistovali žiadne kovové katióny, ktoré by sa dali dostatočne znížiť? V takom prípade budú iné druhy prítomné v strede elektróny: Depolarizadores. Sú dôverne príbuzné s pH: o2, H+, Oh- a h2Ani.
Elektróny kyslíka a vody v reakcii vyjadrenej nasledujúcou chemickou rovnicou:
Ani2 + 2h2O + 4e- => 4OH-
Zatiaľ čo Iones h+ Transformujú sa na H2:
2h+ + 2e- => H2
To znamená, druh druhu- a h2 Sú to bežné produkty galvanických alebo elektrochemických korózií.
Aj keď sa kov R nezúčastňuje na žiadnej reakcii, skutočnosť, že je ušľachtilejšia, že M podporuje jeho oxidáciu; A preto bude existovať väčšia produkcia OH iónov- o Vodíkový plyn. Pretože koniec koncov je to rozdiel medzi redukčnými potenciálmi, AE, jedným z hlavných motorov týchto procesov.
Železná korózia
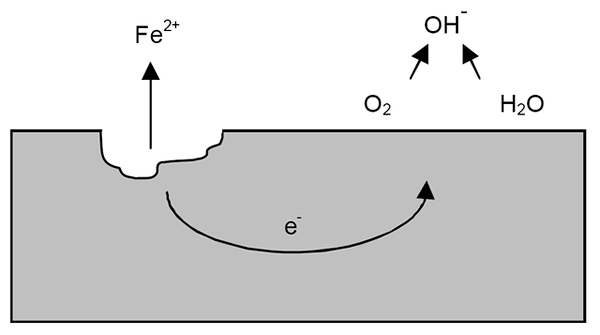 Mechanizmus korózie pre železo. Zdroj: Wikipedia.
Mechanizmus korózie pre železo. Zdroj: Wikipedia. Po predchádzajúcich objasneniach je možné vyriešiť príklad korózie železa (vynikajúci obrázok). Predpokladajme, že existuje tenká vrstva vody, v ktorej sa kyslík rozpúšťa. Bez prítomnosti iných kovov to budú Depolarizadores, ktorí budú označovať reakčné pokyny.
Železo tak stratí niektoré atómy na svojom povrchu, aby sa rozpustili vo vode ako katióny viery2+:
Fe => viera2+ + 2e-
Dva elektróny budú cestovať po železnom kuse za to, že sú dobrým vodičom elektriny. Aby bolo známe, kde sa začala oxidácia alebo anodické miesto; Ale nie tam, kde bude pokračovať redukcia alebo umiestnenie katódového miesta. Katódová stránka môže byť kdekoľvek; A čím vyššia je možná oblasť, horšie bude korózia kovu.
Predpokladajme, že elektróny dosiahli bod, ako je to znázornené na hornom obrázku. Tam je kyslík a voda už opísaná reakcia, ktorou sa OH uvoľňuje-. Tieto anióny oh- Môžu reagovať s vierou2+ Formovať vieru (oh)2, čo vyzráža a trpí následnými oxidáciami, ktoré ho konečne transformujú na hrdzu.
Medzitým anodické miesto prasklo čoraz viac.
Príklady
V každodennom živote sú príklady galvanických korózií početné. Nemusíme sa odvolávať na železnú korunu: akýkoľvek artefakt vyrobený z kovov môže trpieť rovnakým procesom v prítomnosti mokrého a slaného prostredia.
Môže vám slúžiť: fosfátová skupinaOkrem pláže môže zima prispieť aj ideálnymi podmienkami pre koróziu; Napríklad, keď hodíte soli na cestný sneh, aby ste zabránili korčuľovaniu automobilov.
Z fyzikálne. Je to preto, že oba kovy sa správajú ako dve elektródy a najaktuálnejší stratia svoje elektróny.
Ak je to produkcia iónov- Je to značné, dokonca môžete spustiť farbu automobilu alebo príslušného artefaktu.
Anodické indexy
Dá sa vybudovať svoje vlastné príklady galvanických korózií pomocou tabuliek potenciálneho redukcie. Tabuľka anodického indexu (osebe zjednodušia) sa však vyberie na ilustráciu tohto bodu.
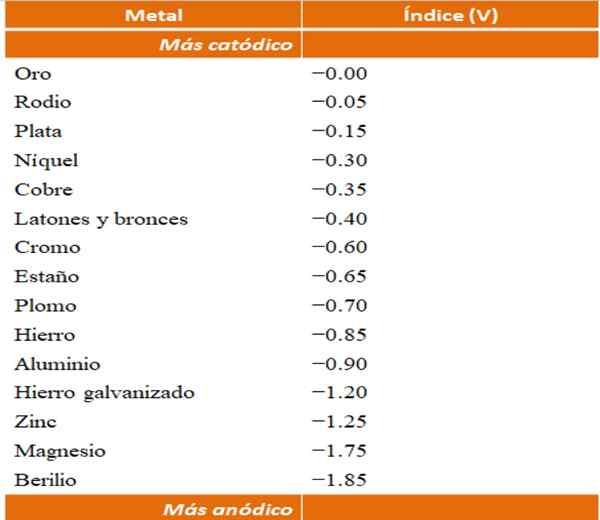 Anodické indexy pre rôzne kovy alebo zliatiny. Zdroj: Wikipedia.
Anodické indexy pre rôzne kovy alebo zliatiny. Zdroj: Wikipedia. Predpokladajme napríklad, že by sme chceli vybudovať elektrochemickú bunku. Kovy, ktoré sú hornou časťou tabuľky anodických indexov, sú viac katóda; to znamená, že sa ľahko znížia, a preto bude ťažké ich mať v riešení. Zatiaľ čo kovy, ktoré sú na spodku.
Ak si vyberieme zlato a berylium, oba kovy nemohli byť spolu po dlhú dobu, pretože berylium by oxidovalo extrémne rýchly.
A ak naopak, máme roztok ag iónov+ A ponoríme do nej hliníkovú tyč, zároveň sa rozpustí, čím sa vyráža častice kovového striebra kovu. Ak sa tento stĺp pripojí k grafitovej elektróde, elektróny by k nemu cestovali, aby elektrochemicky ukladali striebro ako strieborný film.
A ak je namiesto hliníkovej tyče mimo medi, roztok by sa stal modrými prítomnosťou iónov Cu2+ vo vode.
Ochrana pred elektrochemickou koróziou
Obetské povlaky
Predpokladajme, že má chrániť laminu korózie v prítomnosti iných kovov. Najjednoduchšou možnosťou by bolo pridať horčík, ktorý by pokrýval zinok, takže po oxidácii elektróny uvoľňované z horčíka znižujú Zn katióny2+ späť.
Film MGO o zinku skôr ako neskôr by však nakoniec praskol, čo by poskytovalo súčasné miesto s vysokou hustotou; to znamená, že korózia zinku by v týchto bodoch prudko zrýchlila.
Táto technika ochrany pred elektrochemickou koróziou je známa ako použitie obetovania obety. Najznámejší je zinok, ktorý sa používa v slávnej technike nazývanej galvanizáciu. V nich je zakrytý kov M, najmä železo, zinok (viera/Zn).
Môže vám slúžiť: fenolftaleín (C20H14O4)Oxidizuje zinok a jeho oxid slúži na zakrytie železa a prenos elektrónov, ktoré znižujú vieru2+ ktoré sa dajú formovať.
Vznešené povlaky
Predpokladajme, že chcete chrániť ten istý zinkový list, ale teraz sa použije chróm namiesto horčíka. Chróm je ušľachtilejší (viac katód, pozri tabuľku anodických indexov) ako zinok, a preto funguje ako vznešený povlak.
Problém tohto typu povlaku je v tom, že akonáhle praskne, bude podporovať a ďalej urýchliť oxidáciu kovu nižšie; V tomto prípade je zinok skorodovaný ešte viac, ako je pokrytý horčíkom.
A nakoniec, existujú aj ďalšie povlaky, ktoré pozostávajú z obrazov, plastov, antioxidantov, tukov, živíc atď.
Detský experiment
Železná doska v medených soli
Jednoduchý experiment je možné navrhnúť z tej istej tabuľky anodických indexov. Rozpustenie primeraného množstva (menej ako 10 gramov) CUSO4· 5H2Alebo vo vode je dieťa požiadané, aby ponorilo na leštenú železnú dosku. Fotografia sa urobí a proces sa môže vyvíjať na pár týždňov.
Rozpúšťanie je spočiatku modrom, ale začne strácať sfarbenie, zatiaľ čo železná doska získa medenú farbu. Je to preto, že meď je ušľachtilá ako železo, a preto jej katióny Cu2+ Budú sa zredukovať na kovovú meď z iónov priradených oxidáciou železa:
Fe => viera2+ + 2e-
Cu2+ + 2e- => Cu
Čistenie oxidu striebra
Strieborné predmety Čarsnenie v priebehu času, najmä ak sú v kontakte so zdrojom síry. Jeho oxid sa môže odstrániť, ak je objekt ponorený do vodnej vane s hydrogenuhličitom sodným a hliníkovou fóliou. Bikarbonát poskytuje elektrolyty, ktoré uľahčujú prepravu elektrónov medzi objektom a hliníkom.
Výsledkom je, že dieťa môže oceniť, že objekt stráca svoje čierne škvrny a bude žiariť svojou charakteristickou striebornou farbou; Zatiaľ čo hliníková fólia bude bežať až do zmiznutia.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Wikipedia. (2019). Galvanická korózia. Zdroj: In.Wikipedia.orgán
- Stephen nižší. (16. júna 2019). Elektochemická korózia. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Otvorená univerzita. (2018). 2.4 Proces korózie: Galvanická korózia. Získané z: Open.Edu
- Zákaznícka technická služba Brush Wellman Inc. (s.F.). Sprievodca galvanickou koróziou. Kefy s inžinierskymi materiálmi.
- Giorgio Carboni. (1998). Experimenty v Electochemistry. Zdroj: Fensci.com
- « SOPHIST RELATIVISM Pôvod, charakteristiky, príklady
- Štruktúra cyklických uhľovodíkov, vlastnosti, príklady »

