Externá elektronická konfigurácia
- 3222
- 22
- Blažej Hrmo
 Elektronické orbitály. Zdroj: Patricia.Fidi, Wikimedia Commons
Elektronické orbitály. Zdroj: Patricia.Fidi, Wikimedia Commons Čo je externá elektronická konfigurácia?
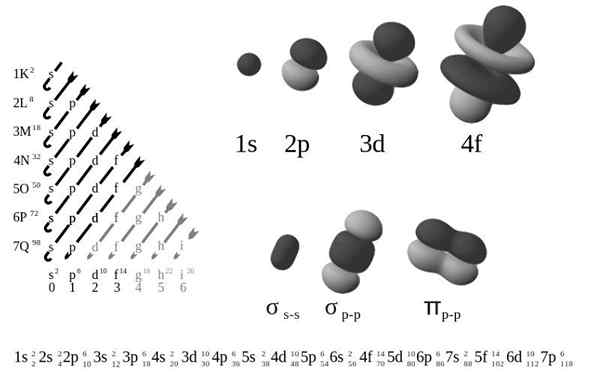
Ten Externá elektronická konfigurácia, Tiež sa nazýva elektronická štruktúra, je to usporiadanie elektrónov na úrovniach a podskupenia energie okolo atómového jadra. Úrovne sú od 1 do 7 a čiastkové úrovne sú S, P, D a F.
Podľa starej atómovej modelu Bohra elektróny zaberajú niekoľko úrovní v obežných dráhach okolo jadra, prvej vrstvy najbližšie k jadru k siedmej vrstve, Q, najvzdialenejšia.
Pokiaľ ide o rafinovanejší kvantový mechanický model, vrstvy K-Q sú rozdelené do sady orbitálov, z ktorých každý môže byť obsadený nie viac ako niekoľkými elektrónmi.
Elektronická konfigurácia sa bežne používa na opis orbitálov atómu v jeho základnom stave, ale môže sa tiež použiť na reprezentáciu atómu, ktorý bol ionizovaný v katióne alebo aninii, a kompenzuje stratu alebo zisk elektrónov v ich príslušných orbitáloch.
Mnoho fyzikálnych a chemických vlastností prvkov môže korelovať s ich jedinečnými elektronickými konfiguráciami. Elektróny Valencia, elektróny vo vonkajšej vrstve, sú určujúcim faktorom pre jedinečnú chémiu prvku.
Základné koncepty elektronických konfigurácií
Pred priradením elektrónov atómu orbitálom sa musí oboznámiť so základnými koncepciami elektronických konfigurácií. Každý prvok periodickej tabuľky pozostáva z atómov, ktoré sa skladajú z protónov, neutrónov a elektrónov.
Elektróny vykazujú záporné zaťaženie a sú okolo jadra atómu na elektrónových orbitáloch, ktoré sú definované ako objem priestoru, v ktorom je možné elektrón nájsť v rámci 95% pravdepodobnosti.
Štyri rôzne typy orbitálov (S, P, D a F) majú rôzne spôsoby a orbitál môže obsahovať maximálne dva elektróny. Orbitály P, D a F majú rôzne čiastkové úrovne, takže môžu obsahovať viac elektrónov.
Môže vám slúžiť: dávkový reaktor: Charakteristiky, časti, aplikácieAko je uvedené, elektronická konfigurácia každého prvku je jedinečná pre jeho polohu v periodickej tabuľke. Hladina energie je určená obdobím a počet elektrónov je daný atómovým počtom prvku.
Orbitály na rôznych úrovniach energie sú navzájom podobné, ale zaberajú rôzne oblasti vo vesmíre.
Orbitál 1S a orbitálna 2s majú charakteristiky orbitálnych S (rádiové uzly, pravdepodobnosť sférického objemu, môžu obsahovať iba dva elektróny atď.). Ale rovnako ako na rôznych úrovniach energie, zaberajú rôzne priestory okolo jadra. Každý orbitál môže byť reprezentovaný konkrétnymi blokmi v periodickej tabuľke.
Blok S je oblasť alkalických kovov vrátane hélia (skupiny 1 a 2), blok D sú prechodné kovy (skupiny 3 až 12), blok P sú prvky hlavnej skupiny skupín 13 A 18 a blok F sú séria lantanidov a aktinidov.
Aufbau
Aufbau pochádza z nemeckého slova Aufbauen, Čo znamená „stavať“. Pri písaní elektrónových konfigurácií v podstate budujeme elektrónové orbitály, keď postupujeme z jedného atómu na druhý.
Keď píšeme elektronickú konfiguráciu atómu, vyplníme orbitály v rastúcom poradí atómového čísla.
Princíp AUFBAU pochádza zo princípu Pauliho vylúčenia, ktorý tvrdí, že v atóme nie sú dve fermiony (napríklad elektróny). Môžu mať rovnakú sadu kvantových čísel, takže musia „akumulovať“ pri vyšších úrovniach energie.
Spôsob, akým sa elektróny hromadia, je problém s konfiguráciou elektrónov.
Stabilné atómy majú toľko elektrónov ako protóny v jadre. Elektróny sa stretávajú okolo jadra v kvantových orbitáloch podľa štyroch základných pravidiel nazývaných princíp AUFBAU.
Môže vám slúžiť: chlorid bária (BACL2)1. V atóme nie sú žiadne dva elektróny zdieľané rovnakými štyrmi kvantovými číslami N, L, M a S.
2. Elektróny najprv zaberajú orbitály najnižšej energetickej úrovne.
3. Elektróny naplnia orbitály vždy rovnakým rotačným číslom. Keď sú orbitály plné, začne sa to.
4. Elektróny vyplnia orbitály pre súčet kvantových čísel n a l. Orbitály s rovnakými hodnotami (n + l) budú vyplnené najskôr s nižšími hodnotami N.
Druhé a štvrté pravidlá sú v podstate rovnaké. Príkladom štvrtého pravidla by boli Orbitals 2p a 3s.
Orbitál 2p je n = 2 a l = 2 a 3s orbitál je n = 3 a l = 1. (N + l) = 4 v obidvoch prípadoch, ale orbitál 2p má najnižšiu energiu alebo nižšiu hodnotu a bude vyplnený pred vrstvou 3s.
Našťastie môžete použiť diagram Moeller, ktorý je uvedený na vyplnenie elektrónov. Graf sa číta vykonaním diagonálov od 1 s.
 Diagram Moeller. Zdroj: Gabriel Bolívar
Diagram Moeller. Zdroj: Gabriel Bolívar Teraz, keď je známe, že poradie orbitálov je vyplnené, jediná vec, ktorá zostáva, je zapamätať si veľkosť každého orbitálu.
Orbitály majú 1 možnú hodnotu ml Obsahovať 2 elektróny
P orbitály majú 3 možné hodnoty ml Obsahovať 6 elektrónov
Orbitály majú 5 možných hodnôt ml Obsahovať 10 elektrónov
F Orbitals majú 7 možných hodnôtl Obsahovať 14 elektrónov
To je všetko, čo je potrebné na určenie elektronickej konfigurácie stabilného atómu prvku.
Napríklad vezmite dusíkový prvok. Dusík má sedem protónov, a preto sedem elektrónov. Prvým orbitálom, ktorý vyplní, je orbitál 1s.
Orbitál má dva elektróny, takže zostáva päť elektrónov. Ďalším orbitálom je orbitál 2S a obsahuje ďalšie dva. Tri konečné elektróny pôjdu na orbitál 2p, ktorý môže obsahovať až šesť elektrónov.
Môže vám slúžiť: karboxymetylcelulózaDôležitosť externej elektronickej konfigurácie
Konfigurácie elektrónov zohrávajú dôležitú úlohu pri určovaní atómových vlastností.
Všetky atómy tej istej skupiny majú rovnakú externú elektronickú konfiguráciu s výnimkou atómového čísla n, a preto majú podobné chemické vlastnosti.
Niektoré z kľúčových faktorov, ktoré ovplyvňujú atómové vlastnosti.
Väčšina atómových vlastností môže súvisieť s stupňom príťažlivosti medzi elektrónmi vonkajšími jadrom a počtom elektrónov vo vonkajšej vrstve elektrónov, počtom valenčných elektrónov.
Elektróny vonkajšej vrstvy sú tie, ktoré môžu tvoriť kovalentné chemické väzby, ktoré majú schopnosť iónu tvoriť katióny alebo anióny a tie, ktoré dávajú oxidačný stav chemickým prvkom.
Určia tiež atómový polomer. Keď sa n zväčšuje, zvyšuje sa atómový polomer. Keď atóm stratí elektrón, dôjde k kontrakcii atómového polomeru v dôsledku poklesu negatívneho zaťaženia okolo jadra.
Elektróny vonkajšej vrstvy sa berie do úvahy teóriou Valencia Link, teória kryštalického poľa a molekulárnej orbitálnej teórie, aby sa získali vlastnosti molekúl a hybridizácie väzieb.
Odkazy
- Aufbau hlavný. Chémia obnovená.Librettexts.orgán.
- Bozeman Science. Konfigurácia elektrónov. Obnovené z YouTube.com.
- Konfigurácie elektrónov a vlastnosti atómov. Zotavené z Oneonty.Edu.

