Chemická deliteľnosť
- 4040
- 1039
- Gabriel Bahna
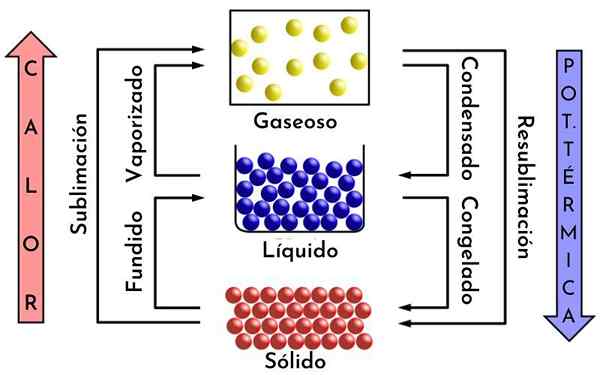
 Transformácia hmoty, príklad deliteľnosti na chémiu. Zdroj: Mikerun, CC BY-SA 4.0, Wikimedia Commons
Transformácia hmoty, príklad deliteľnosti na chémiu. Zdroj: Mikerun, CC BY-SA 4.0, Wikimedia Commons Čo je chemická deliteľnosť?
Môžeme definovať Chemická deliteľnosť ako vlastnosť hmoty, ktorá vám umožňuje oddeliť sa v menších častiach. Aby sme pochopili koncept, môžeme uviesť príklad.
Ak sa roztaví ľadová kocka, stáva sa vodou a keď je vystavená teplu, transformuje sa na paru. Túto paru sa dá naopak rozdeliť na molekuly a tieto, na atómy.
Chemická deliteľnosť je teda možnosť rozdelenia na stále malé časti.
Pôvod a koncept chemickej deliteľnosti
Dlho sa diskutovalo o tom, či sa táto záležitosť skladala z častíc (čo dnes vieme ako atómy), všeobecnou myšlienkou bolo, že záležitosť bola kontinuum, ktoré sa dá rozdeliť.
Tento zovšeobecnený koncept sa stal obeťou výsmechu brilantným vedcom, ako je James Clerk Maxwell (Maxwellove rovnice) a Ludwig Boltzman (z Boltzmanovej distribúcie) niečo, čo prvé pretiahlo šialenstvo a druhý na samovraždu.
V 5. storočí.C., Grécky filozof Leucipo a jeho demokritský učeník použili slovo atóm na označenie najmenšej individuálnej hmoty a navrhli, že svet nepostáva viac ako z pohybu atómov.
Táto skorá atómová teória sa líšila od neskorších verzií, pretože zahŕňala myšlienku ľudskej duše zloženej z rafinovanejšieho typu atómu distribuovaného telom.
Atómová teória klesla v stredoveku, ale oživila sa na začiatku vedeckej revolúcie v sedemnástom storočí.
Napríklad Isaac Newton veril, že hmota pozostáva z „tuhých, masívnych, tvrdých, nepreniknuteľných a mobilných častíc“.
Môže vám slúžiť: Molekulárny vzorec: Ako ho dostať von, príklady a cvičeniaDeliteľnosť môže byť poskytnutá rôznymi metódami: najbežnejšou je deliteľnosť fyzickými metódami, ako je sekanie jablka nožom.
Deliteľnosť však môže byť poskytnutá aj chemickými metódami, kde by sa hmota rozdelila na molekuly alebo atómy.
Príklady chemickej deliteľnosti
1. Rozpustiť soľ
Ak sa soľ rozpustí napríklad chlorid sodný, vo vode, dochádza k javu solvatácie, keď sú rozbité iónové väzby soli:
NaCl → NA+ + Cl-
Rozpustením iba zrna soli vo vode sa v roztoku rozdelí na miliardy sodíkových a chloridových iónov.
2. Oxidácia kovov v kyslom médiu
Všetky kovy, napríklad horčík alebo zinok, reagujú s kyselinami, ako je zriedená kyselina chlorovodíková, čím sa poskytnú vodíkové bubliny a bezfarebný roztok kovového chloridu.
Mg + hcl → mg2+ +Cl- + H2
Oxidová na kovovú kyselinu oddelením kovových väzieb, aby sa získali ióny v roztoku.
3. Hydrolýza esterov
Hydrolýza je prasknutie chemickej väzby pomocou vody. Príkladom hydrolýzy je hydrolýza esterov, kde sú rozdelené do dvoch molekúl, alkoholu a karboxylovej kyseliny.
4. Eliminačné reakcie
Eliminačná reakcia robí presne to, čo hovorí: eliminuje atómy molekuly. To sa deje na vytvorenie dvojitého väzby uhlíka a uhlíka. To sa dá urobiť pomocou základne alebo kyseliny.
Môže sa vyskytnúť v jednom spoločnom kroku (abstrakcia protónu v Ca, ktorý sa vyskytuje v rovnakom čase ako rozdelenie Cp-X Link) alebo v dvoch krokoch (rozdelenie odkazu Cp-X sa vyskytuje ako prvé, aby sa vytvorili pri prvom medziprodukt, ktorý sa potom „vypne“ abstrakciou protónu v alfa-uhlíku).
Môže vám slúžiť: Darmstadtio: Discovery, Štruktúra, vlastnosti, použitia5. Enzymatická reakcia aldolázy
V prípravnej fáze glykolýzy je molekula glukózy rozdelená na dva molekuly glyceraldehydu 3-fosfát (G3P) s použitím 2 ATP.
Enzým, ktorý je zodpovedný za tento rez.
6. Degradácia biomolekúl
Príkladom chemickej deliace.
Dôvodom je skutočnosť, že veľké molekuly, ako sú uhľohydráty, mastné kyseliny a proteíny, na výrobu menších molekúl, ako je acetyl COA, ktoré vstupujú do cyklu Krebs, aby sa vytvorila energia vo forme ATP.
7. Spaľovacie reakcie
Toto je ďalší príklad chemickej deliteľnosti, pretože komplexné molekuly, ako je propán alebo bután, reagujú s kyslíkom na výrobu CO₂ a voda:
C3H8 + 52 → 3Co2 + 4H2Ani
Degradáciu biomolekúl možno povedať, že ide o spaľovaciu reakciu, pretože konečné produkty sú co₂ a voda, ale vyskytujú sa v mnohých krokoch s rôznymi sprostredkovateľmi.
8. Odstredenie krvi
Oddelenie rôznych zložiek krvi je príkladom deliteľnosti. Napriek tomu, že ide o fyzický proces, príklad je zaujímavý, pretože zložky podľa hustoty sú oddelené odstredením.
Najhustejšie komponenty, sérum s červenými krvinkami, zostanú na spodnej časti odstredivej trubice, zatiaľ čo čím menej husté, plazma, zostane v hornej časti v hornej časti.
Môže vám slúžiť: neutrálny atóm9. Hydrogenuľový nárazník
Hydrogenuhličitan sodný, HCO3-, Je to hlavný spôsob transportu CO₂ v telesnom produkte reakcií metabolickej degradácie.
Táto zlúčenina reaguje so stredným protónom za vzniku kyseliny uhličitej, ktorá sa následne rozdelí na CO₂ a vodu:
HCO3- + H+ D h2Co3 D co₂ + h₂o
Pretože reakcie sú reverzibilné, je to spôsob, ako má telo dýchaním kontrolovať fyziologické pH, aby sa predišlo alkalóze alebo acidózovým procesom.
10. Jadrový atóm alebo štiepenie
V prípade, že je rozbité masívne jadro (napríklad urán-235), povedie k čistej energetickej výkonnosti čistou energetickou výkonnosťou. Je to preto, že súčet mas fragmentov bude menší ako hmotnosť uránového jadra.
V prípade, že hmotnosť fragmentov je rovná alebo väčšia ako hmotnosť železa v vrchole krivky energetiky Link, jadrové častice budú bližšie spojené ako v jadre uránu a ktoré sa znižujú v energetickej forme podľa energetickej formy podľa do Einsteinovej rovnice.
Pre prvky ľahšie ako železo bude fúzia produkovať energiu. Tento koncept viedol k vytvoreniu atómovej bomby a jadrovej energie.
Odkazy
- Reakcie na kyseliny. BBC sa zotavila.co.Uk.
- Foist, L. (S.F.). Eliminačné reakcie v organickej chémii. Zotavená štúdia.com.
- Jadrová fikcia (s.F.). Zotavené z hyperfyziky.

