Štruktúra chromátu zinku, vlastnosti, získanie, použitie

- 4259
- 283
- Gabriel Bahna
On chromát zinku O CINC chromát je anorganická zlúčenina tvorená prvkami zinočnatého (Zn), chrómu (CR) a kyslíka (O) (O). Má Zn ióny2+ a cro42-. Jeho chemický vzorec je Zncro4.
Pojem „chromát zinku“ komerčne slúži na označenie troch zlúčenín s rôznou molekulárnou štruktúrou: a) chromát správny Zink Zink4, b) Základný chromát FIFCRO4• 4ZN (OH)2, a (c) základný chromát zinku a 3Zncro draslíka4• Zn (OH)2• K2Croch4• 2h2Ani.
 Štruktúra chromátu zinku. Autor: Marilú Stea.
Štruktúra chromátu zinku. Autor: Marilú Stea. Používa sa hlavne v maľbách alebo fondoch, ktoré chránia korózne kovy. Za týmto účelom je zmiešaný s obrazmi, lakmi a polymérmi, ktoré sa potom aplikujú na povrch kovov.
Používa sa tiež v dekoratívnych a ochranných povrchoch dosiahnutých s inými chromátmi a kyselinami, ktoré poťahujú rôzne objekty, ako sú nástroje. Slúži tiež na udržanie elektrickej vodivosti kovových častí.
Používa sa ako katalyzátor pri hydrogenácii reakcií (pridanie vodíka) do organických zlúčenín. Je súčasťou pigmentov, ktoré sa predtým používali v umeleckých obrazoch.
Je to materiál, ktorý produkuje rakovinu, a to preto, že chromát má chróm v oxidačnom stave +6.
[TOC]
Štruktúra
 Zincro's Chromate4 Je to žltá zlúčenina. Autor: Marilú Stea.
Zincro's Chromate4 Je to žltá zlúčenina. Autor: Marilú Stea. Zinkový chromát je iónová zlúčenina tvorená pätnástimi katiónmi Zn2+ a anión Cromato42-. Ten je tvorený Chrome s Valencia +6 (Hexavalent Chrome, Cr6+) a štyri atómy kyslíka s oxidačným stavom -2.
Zn ión2+ Má nasledujúcu elektronickú štruktúru:
1s2, 2s2 2 P6, 3s2 3p6 3D10.
Pokiaľ ide o hexavalentný chróm, má na svojich elektronických orbitáloch nasledujúcu konformáciu:
1s2, 2s2 2 P6, 3s2 3p6.
Obe štruktúry sú veľmi stabilné, pretože orbitály sú úplné.
Menovanie
- Chromát zinku
- Chrómová zinočnatá soľ
- Zinková žltá (aj keď s týmto výrazom sa nazývajú aj iné zlúčeniny obsahujúce Zncro4).
Vlastnosti
Fyzický stav
Žltá žltá kryštalická pevná látka. Hranoly -podľa kryštálov na tvare.
Molekulová hmotnosť
181,4 g/mol
Bod topenia
316 ° C
Hustota
3,40 g/cm3
Rozpustnosť
Vo vode rozpustné vo vode: 3,08 g/100 g h2Ani. Ľahko sa rozpustí v kyselinách a kvapalnom amoniaku. Nerozpustný v acetone.
Môže vám slúžiť: ionizačná konštantapH
Podľa niektorých zdrojov sú ich vodné roztoky kyslé.
Chemické vlastnosti
Je to silne oxidačná zlúčenina, takže môže reagovať s redukčnými činidlami generujúcimi teplo. Medzi látkami, s ktorými môžu organické, môžu reagovať, ako sú kyanidy, estery a tiociáty. Môžete tiež zaútočiť na niektoré kovy.
Vo vodnom roztoku predstavuje chrómový ión rôzne zostatky v závislosti od pH a tvorby rôznych druhov.
Druhy tvorené chromátom
Nad pH 6 je prítomný Cromato ión42- (žltá); Medzi pH 2 a pH 6 sú ión HCRO v rovnováhe4- a Cr Dichromát2Ani72- (oranžová červená); Pri pH menej ako 1 je hlavný druh h2Croch4.
Keď sa do týchto vodných roztokov pridá katión zinku (II)4.
Zostatky sú nasledujúce:
HCRO4- ⇔ cro42- + H+
H2Croch4 ⇔ HCRO4- + H+
Cr2Ani72- + H2Alebo ⇔ 2 HCRO4-
V základnom médiu nastane nasledujúce:
Cr2Ani72- + Oh- ⇔ HCRO4- + Croch42-
HCRO4- + Oh- ⇔ cro42- + H2Ani
Zncro4 Nereaguje rýchlo so vzduchom alebo vodou.
Získanie
Môže sa produkovať reakciou vodného bahna oxidu zinočnatého alebo hydroxidu s rozpustenou chromatickou soľou a potom neutralizáciou.
Priemyselne sa používa proces Cronak, v ktorom je kovová hmla ponorená do roztoku dichromátu sodného (NA2Cr2Ani7) a kyselina sírová (h2SW4).
Môže sa tiež pripraviť tým, že ho vyzráža z roztokov, v ktorých sú rozpustené soli zinku a chromátu:
Klimatizovať2Croch4 + Znso4 → Zncro4↓ + k2SW4
Žiadosti
Ochrana kovu
V metalurgickom priemysle sa používa hlavne v pozadí maľby (prípravná farba alebo počiatočný povlak) aplikovaný na kovy, na ktoré poskytuje odolnosť proti korózii.
Používa sa ako pigment v maľbách a lakoch, ktoré sa vkladá do matrice organického polyméru.
Tento typ farieb sa podáva do potrubí, olejových nádrží, oceľových konštrukcií, ako sú mosty, elektrické prenosové veže a časti automobilov na inhibíciu korózie.
 Oceľové konštrukcie mostov sú natreté základňou chromátu zinku pred konečnou farbou, aby sa chránila pred koróziou. Autor: オギクボ マンサク. Zdroj: Pixabay.
Oceľové konštrukcie mostov sú natreté základňou chromátu zinku pred konečnou farbou, aby sa chránila pred koróziou. Autor: オギクボ マンサク. Zdroj: Pixabay. Pasivácia
Chráni tiež kovové komponenty pokryté zinkom, ktoré boli prenášané pomocou alkalických kovových chromátov. Pasivácia spočíva v strate chemickej reaktivity za určitých podmienok prostredia.
Môže vám slúžiť: elektrochemické bunkyTieto povlaky tiež slúžia ako dekoratívne povrchové úpravy a zachovajú elektrickú vodivosť. Bežne sa vzťahujú na denné články, ako sú náradie a môžu byť rozpoznané podľa ich žltej farby.
 Niektoré nástroje sú pokryté zinkovým chromátom. Autor: Duk. Zdroj: Wikimedia Commons.
Niektoré nástroje sú pokryté zinkovým chromátom. Autor: Duk. Zdroj: Wikimedia Commons. Ako to funguje
Niektorí vyšetrovatelia zistili, že ochrana proti korózii kovov uskutočňovaných fi -chromátom by mohla byť spôsobená skutočnosťou, že inhibuje rast húb. Tým.
Iné štúdie naznačujú, že antikorózny účinok by mohol byť preto, že zlúčenina urýchľuje tvorbu ochranných oxidov na kovy.
 Antikorózne pozadie zinočnatého chromátu na ochranu povrchu kovu. 水水/cc By-SA (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons.
Antikorózne pozadie zinočnatého chromátu na ochranu povrchu kovu. 水水/cc By-SA (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons. Katalýza reakcií
Táto zlúčenina sa používa ako katalyzátor v rôznych chemických reakciách, ako je hydrogenácia oxidu uhoľnatého (CO) na získanie metanolu (CH3Oh).
Estery sa môžu previesť na primárne alkoholy hydrogenáciou, pomocou tejto zlúčeniny na urýchlenie reakcie.
Podľa niektorých vedcov je jej katalytický účinok spôsobený skutočnosťou, že tuhá látka nepredstavuje stechiometrickú štruktúru, to znamená, že sa odchyľuje od svojho vzorca Zncro4 A je to skôr:
Zn1-xCr2-xAni4
Čo znamená, že v štruktúre sú defekty, ktoré energicky uprednostňujú katalýzu.
Ostatné aplikácie
Nachádza sa v niektorých mastných farbách, slúži na tlač, je činidlom pre povrchové ošetrenie, aplikuje sa vo podlahách podlah a je činidlom v chemických laboratóriách.
Prerušené použitie
Od štyridsiatych rokov 20. storočia sa použil derivát Zncro4, Zinok a medený chromát, ako listové fungicídy pre rastliny zemiakov.
 Pápež. Autor: Dirk (Beeki®) Schumacher. Zdroj: Pixabay.
Pápež. Autor: Dirk (Beeki®) Schumacher. Zdroj: Pixabay. Toto použitie už bolo opustené toxicitou a škodlivými účinkami zlúčeniny.
V umeleckých obrazoch devätnásteho storočia sa našla prítomnosť komplexnej soli chromátu zinku, 4Zncro4• K2Alebo • 3h2O (zinkový chromát a hydratovaný draslík), čo je žltý pigment nazývaný citrónová žltá.
Môže vám slúžiť: chlorid lítium (LICL): vlastnosti, riziká a použitiaRiziká
Aj keď to nie je palivo, pri zahrievaní emituje toxické plyny. Môže explodovať, ak prídete do styku s redukčnými látkami alebo organickými materiálmi.
Prach dráždi oči a alergickú reakciu produkujúcu pokožku. Jeho vdýchnutie spôsobuje podráždenie nosa a krku. Ovplyvňuje pľúca, spôsobuje skrátenie, bronchitídu, pneumóniu a astmu.
Jeho požitie ovplyvňuje tráviaci trakt, pečeň, obličky, centrálny nervový systém, vytvára obehový kolaps a poškodzuje imunitný systém.
Generátor rakoviny
Je to potvrdený karcinogén, zvyšuje riziko rakoviny pľúc a nosnej dutiny. Je toxický pre bunky (cytotoxický) a tiež poškodzuje chromozómy (genotoxické).
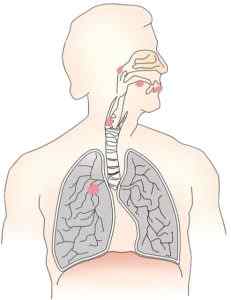 Zinkový chromát produkuje rakovinu pľúc a dýchacie cesty. Autor: OpenClipart-vektory. Zdroj: Pixabay.
Zinkový chromát produkuje rakovinu pľúc a dýchacie cesty. Autor: OpenClipart-vektory. Zdroj: Pixabay. Zistilo sa, že toxicita a karcinogenita tejto zlúčeniny sú spôsobené hlavne pôsobením chrómu v oxidácii +6. Prítomnosť CINC však produktu dáva neriešiteľnosť, čo tiež ovplyvňuje škody, ktoré spôsobuje.
Účinky na životné prostredie
Je to veľmi toxické pre zvieratá a pre vodný život, čo spôsobuje škodlivé účinky, ktoré trvajú v priebehu času. Tento chemik môže byť bioakumulovaný v celom potravinovom reťazci.
Zo všetkých týchto dôvodov sú procesy, ktoré zahŕňajú chromáty (hexavalentné chróm).
Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Chromát zinku. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Olovo, D.R. (Editor) (2003). Príručka chémie a fyziky CRC. 85th CRC Press.
- Xie, h. a kol. (2009). Chróm zinku vyvoláva chromozómovú nestabilitu a prelomenie DNA doble v ľudských bunkách Lun. Toxicol Appl Pharmacol 2009 1. februára; 234 (3): 293-299. NCBI sa zotavila.NLM.NIH.Vláda.
- Jackson, R.Do. a kol. (1991). Katalytická aktivita a defektná štruktúra chromátu zinku. Catal Lett 8, 385-389 (1991). Odkaz obnovený.Prubár.com.
- Yahalom, J. (2001). Metódy ochrany korózie. V encyklopédii materiálov: veda a technológia. Zotavené z vedeckých pracovníkov.com.
- Cudzinec-Johannessen, m. (1988). Antimikrobiálny účinok pigmentov v ochranných farbách korózie. V Houchton D.R., Eggins, h.Ani.W. (eds) Biodeteriotion 7. Odkaz obnovený.Prubár.com.
- Barrett, a.G.M. (1991). Zníženie. Pri porozumení organickej syntézy. Zotavené z vedeckých pracovníkov.com.
- Thurson, h.W. a kol. (1948). Chromáty ako zemiakové fungicídy. American Potato Journal 25, 406-409 (1948). Odkaz obnovený.Prubár.com.
- Lynch, R.F. (2001). Zinok: legovanie, termochemické spracovanie, vlastnosti a aplikácie. V encyklopédii materiálov: veda a technológia. Zotavené z vedeckých pracovníkov.com.
- Ramesh Kumar, a.Vložka. a nigam, r.Klimatizovať. (1998). Mössbauerová spektroskopická štúdia korózie produktov pod prvou povlakom obsahujúcou antikorózne pigmenty. J Radioanal Nucl Chem 227, 3-7 (1998). Odkaz obnovený.Prubár.com.
- Otero, v. a kol. (2017). Bária, zinok a žlté na zinok na konci 19. storočia olejomaľby 20. storočia. Herit Sci 5, 46 (2017). Zotavené z HeritagescienceJournal.Springeropen.com.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Wikipedia (2020). Chromát zinku. Získaný z.Wikipedia.orgán.
- Wikipedia (2020). Chrómový konverzný povlak. Získaný z.Wikipedia.orgán.
- « Tichomorský požiarny pás, charakteristiky, hlavné sopky
- Štruktúra chloridu zinočnatého (ZNCL2), vlastnosti, získanie, použitia »

