Štruktúra chloridu železa (III), vlastnosti, získanie, použitia
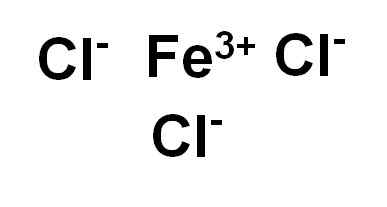
- 4298
- 410
- MUDr. Miloslav Habšuda
On chlorid železa (III) Je to anorganická zlúčenina tvorená železom (viera) a chlórskymi prvkami (CL). Jeho chemický vzorec je fecl3. Je to kryštalická tuhá látka, ktorej farba môže byť od oranžovej po čiernu hnedú.
Fecl3 Ľahko sa rozpustí vo vode tvoriaci kyslý vodný roztok.
 Chlorid železa (III) alebo železitý chlorid fecl3 tuhý. Егор осин/CC BY-SA (https: // creativecommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons.
Chlorid železa (III) alebo železitý chlorid fecl3 tuhý. Егор осин/CC BY-SA (https: // creativecommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons. Chlorid železa (III) sa používa na sedimentovanie častíc, ktoré znečisťujú mestskú alebo priemyselnú odpadovú vodu. Hovorí sa, že vám umožňuje odstrániť niektoré parazity a slúžiť na zastavenie straty krvi zo zvierat u zvierat a na uzdravenie týchto.
Slúži na extrahovanie meďnatiny (II) minerálov sulfidov meďnatého. Používa sa tiež v rôznych chemických reakciách a analýze biologických a chemických laboratórií. Napríklad slúži na detekciu zlúčenín ako fenoly v olejoch extrahovaných z rastlín. Používa sa v elektronických obvodoch, v koženín a fotografovaní.
Za to, že som fecl3 Kyslá zlúčenina je korozívna pre pokožku a sliznice. Je potrebné vyhnúť sa prachu tejto zlúčeniny. Nemalo by sa vyradiť do životného prostredia.
[TOC]
Štruktúra
Chlorid železa (III) alebo železitý chlorid fecl3 Je to iónová zlúčenina a je tvorená vierou železitou3+ a tri ióny chlorid cl-. Železo je v oxidačnom stave +3 a každý chlór má valenciu -1.
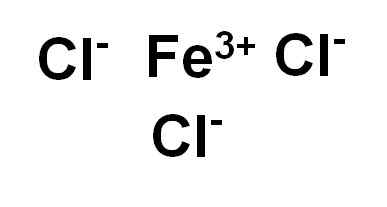 Chlorid železa (III) alebo chlorid železitý. Autor: Marilú Stea.
Chlorid železa (III) alebo chlorid železitý. Autor: Marilú Stea. Menovanie
- Chlorid železa (III)
- Chlorid železitého
- Železný trichlorid
- Železná krivka
Vlastnosti
Fyzický stav
Kryštalická tuhá oranžová až čierna hnedá.
 Feric chlorid fecl3 bezvodý (bez vody). Leiem/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons.
Feric chlorid fecl3 bezvodý (bez vody). Leiem/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons. Molekulová hmotnosť
Anhidro fecl3 = 162,2 g/mol
Bod topenia
Anhidro fecl3 = 304 ° C
Hexahydrát3 •6H2O = 37 ° C
Bod varu
Anhidro fecl3 = Približne 316 ° C
Hexahydrát3 •6H2O = 280-285 ° C
Hustota
Anhidro fecl3 = 2,90 g/cm3 pri 25 ° C
Rozpustnosť
Veľmi rozpustné vo vode: 74,4 g/100 g vody pri 0 ° C; 535,7 g/100 g vody pri 100 ° C. Veľmi rozpustný v acetóne, etanolu, éteru a metanole. Slabo rozpustné v nepolárnych rozpúšťadlách ako benzén a hexán.
Môže vám slúžiť: Bór: História, vlastnosti, štruktúra, použitiepH
Jeho vodné roztoky sú veľmi kyslé. Roztok 0,1 mólov FECL3 na liter vody má pH 2,0.
Chemické vlastnosti
Keď sa výbuch rozpustí vo vode3 Je hydrolyzovaný; to znamená, že sa oddeľuje vo svojich vieru iónov3+ a 3 CL-. Vernosť3+ Vytvorte hexaacuohierro ión [viera (h2Buď)6]3+ Ale to je kombinované s OH iónmi- vody tvoriace zmiešané druhy a uvoľňujúce protóny h+.
Z tohto dôvodu sú ich roztoky kyslé. Ak sa pH zvyšuje, tieto druhy tvoria gél a vytvára sa zrazenina alebo tuhá látka viery s hydratovaným oxidom železitého2Ani3 •NH2Ani.
Kryštály chloridu železa (III) sú hygroskopické, to znamená, že absorbujú vodu z prostredia. Keď je mokrý, je korozívny pre hliník a mnoho kovov.
 Fecl riešenia3 Môžu byť veľmi kyslé a korozívne, pretože obsahujú HCL. Kanesskong/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons.
Fecl riešenia3 Môžu byť veľmi kyslé a korozívne, pretože obsahujú HCL. Kanesskong/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons. Fecl vodné roztoky3 Sú veľmi kyslé a korozívne pre väčšinu kovov. Majú slabú vôňu kyseliny HCL hydrochlorovodíkovej. Keď sa FECL zahrieva až do jeho rozkladu3 emituje vysoko toxické plyny HCL.
Získanie
Chlorid železa (III) sa vytvára priamou chloráciou železa reakciou suchého chlóru (CL2) So železným šrotom (viera) pri 500-700 ° C.
Reakcia sa vykonáva v reaktore rezistentného na kyslé. Prvým krokom je topenie pri 600 ° C zmesi chloridu železa (III) (FECL3) a chlorid draselného (KCl).
 Fecl3 Musí sa pripraviť v nádob. Autor: Johannes Plenio. Zdroj: Pixabay.
Fecl3 Musí sa pripraviť v nádob. Autor: Johannes Plenio. Zdroj: Pixabay. Potom sa železný šrot (viera) rozpustí v tejto roztavenej zmesi, kde železo reaguje s FECL3 A stáva sa chloridom železitým (fecl2).
Fe + 2 fecl3 → 3 fecl2
Potom fecl2 reaguje s chlórom Cl2 formovanie fecl3 ktoré sublimuje (prechádza priamo z pevného stavu do plynného) a zhromažďuje sa v špeciálnych kondenzačných komorách.
2 fecl2 + Cl2 → 2 fecl3
Môžete tiež reagovať na železný feso sulfát4 s chlórom CL2.
Hexahydrát3 •6H2O Dá sa získať odparovaním vodného riešenia viery iónov3+ a cl- V parnom kúpeli.
Môže vám slúžiť: kvartérne zlúčeniny: Charakteristiky, školenie, príkladyPrítomnosť v prírode
Chlorid železa alebo chlorid železa (III) sa nachádza vo forme vo forme minerálu Mo -minerálu, ktorý sa nachádza v láve aktívnych sopiek fumarolov. Medzi sopky, kde nájdete, je Mount Vesubio.
 Fecl3 Je súčasťou rudy Moysite, ktorá je v aktívnej sopke. Autor: Skeze. Zdroj: Pixabay.
Fecl3 Je súčasťou rudy Moysite, ktorá je v aktívnej sopke. Autor: Skeze. Zdroj: Pixabay. Žiadosti
Pri čistení odpadových vôd
Chlorid železitý sa používa na liečbu komunálnej alebo priemyselnej odpadovej vody chemickou sedimentáciou.
Pôsobí ako koagulant, ktorý uprednostňuje spojenie niekoľkých častíc medzi sebou, a tak sa tvoria konglomeráty alebo väčšie častice, ktoré majú tendenciu flokulárne alebo sedimenty (znižujú svoju vlastnú hmotnosť na spodnú časť spracovanej vody).
 Fecl3 Používa sa na oddelenie nežiaducich materiálov od vôd vyradených spoločenstvami alebo priemyselnými odvetviami. Autor: 后园 卓. Zdroj: Pixabay.
Fecl3 Používa sa na oddelenie nežiaducich materiálov od vôd vyradených spoločenstvami alebo priemyselnými odvetviami. Autor: 后园 卓. Zdroj: Pixabay. Týmto spôsobom je uprednostňované oddelenie vodných tuhých látok, ktoré neobsahujú nechcené materiály.
Tento typ ošetrenia môže uľahčiť odstránenie parazitov, ako je napríklad protozoa, ktoré sú mikroorganizmami tvorené jedinou bunkou, ako sú AMIBA, ktoré spôsobujú ochorenie.
Z tohto dôvodu fecl3 Používa sa tiež na čistenie vody.
Vo veterinárnych liečebných postupoch
Chlorid železa (III) sa používa na liečbu zranení zvierat.
Slúži ako lokálny astringent (môžete stiahnuť tkanivá a pôsobiť ako protizápalové a hojenie) a hemostatické (zastavuje krvácanie alebo straty krvi).
Používa sa v práškoch na zastavenie straty krvi alebo keď sú kone prerezané na hovädzí dobytok. Používa sa tiež v roztoku na zastavenie krvácania, keď sú pazúry vyrezané alebo bradavice sa vylučujú.
 Fecl3 Používa sa v práškoch aplikovaných na kravy rezané rohy a vyhýbajú sa infekciám. Autor: Jaclou DL. Zdroj: Pixabay.
Fecl3 Používa sa v práškoch aplikovaných na kravy rezané rohy a vyhýbajú sa infekciám. Autor: Jaclou DL. Zdroj: Pixabay. Používa sa tiež na liečbu faryngitídy (zápal hltanu) alebo stomatitídu (zápal perorálnej sliznice) a na zvýšenie krvného hemoglobínu u niektorých vtákov.
Pri extrakcii kovu
Chlorid železa (III) alebo železitý chlorid fecl3 Používa sa na extrahovanie medi (II) medi, ktorá obsahuje sulfidy uvedeného kovu.
Môže vám slúžiť: hydroxidyJe to oxidačná metóda, ktorá je primeraná na zabránenie uvoľňovaniu oxidu siričitého s siričivým plynom (tak2), pretože namiesto toho sa generuje síra (s). Vyrábajú sa roztoky s vysokými koncentráciami FECL2, Fecl3, Cucl2 a ďalšie kovové chloridy.
4 fecl3 + Cu2S ⇔ 4 fecl2 + 2 CUCL2 + S ↓
Ako činidlo chemických a biologických laboratórií
Medzi mnohými jej použitiami chémie slúži na označenie prítomnosti fenolovej skupiny (tj skupinovej -OH pripojenej k benzénovému kruhu).
Zlúčenina sa rozpustí tak, aby sa analyzovala v etanole a pridá sa niekoľko kvapiek roztoku FECL3. Keď má zlúčenina skupinu -oh pripevnená k benzénovému kruhu (to znamená, že je to fenol), tvorí sa moderné zelené sfarbenie.
Tento test umožňuje analyzovať prítomnosť fenolov v rastlinných extraktoch.
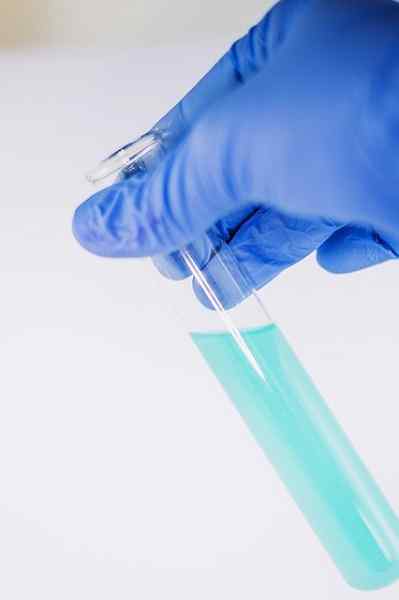 Fecl3 V prítomnosti fenolov dáva moderné zelené sfarbenie. Autor: Ewa Urban. Zdroj: Pixabay.
Fecl3 V prítomnosti fenolov dáva moderné zelené sfarbenie. Autor: Ewa Urban. Zdroj: Pixabay. Používa sa tiež v testoch na stanovenie antioxidačnej aktivity určitých olejov extrahovaných zo zeleniny.
Ďalšou z jej aplikácií je to, že umožňuje pripraviť ďalšie chemické zlúčeniny. Môže tiež pôsobiť ako oxidačné, chlorinujúce činidlo (zabezpečiť chlór) a kondenzátor (aby sa navzájom spojili dve alebo viac molekúl).
Slúži tiež ako katalyzátor alebo urýchľovač reakcií organickej chémie.
V niekoľkých aplikáciách
Chlorid železitý sa používa v tlačených elektronických obvodoch. Zafarbením rôznych hydratovaných foriem slúži ako pigment a používa sa v kožovke kože.
 Fecl3 Používa sa v opaľovaní kože. Autor: pexels. Zdroj: Pixabay.
Fecl3 Používa sa v opaľovaní kože. Autor: pexels. Zdroj: Pixabay. Je to dezinfekčný. Používa sa na liečbu kožných porúch a používa sa aj vo fotografii.
Riziká
Prášok3 Je to dráždi pre oči, nos a ústa. Ak vdych môže spôsobiť kašeľ alebo ťažkosti s dýchaním. Je to korozívna zlúčenina, takže predĺžený kontakt s pokožkou a očami alebo sliznicami môže spôsobiť začervenanie a popáleniny.
Nie je to horľavé, ale keď sa zahrieva pri vysokých teplotách.
Fecl3 Je to škodlivé pre vodné a pozemné organizmy. Ak je náhodou vyradená do životného prostredia, musí sa neutralizovať jej kyslosť so základnými zlúčeninami.
Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Chlorid železitého. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Kirk-Othmer (1994). Encyklopédia chemickej technológie. Zväzok 19. Štvrté vydanie. John Wiley & Sons.
- Ullmannova encyklopédia priemyselnej chémie. (1990). Piaty vydanie. Zväzok A22. VCH Verlagsgellschaft MBH.
- Ngameni, b. a kol. (2013). Flavonoidy a príbuzné zlúčeniny z liečivých rastlín Afriky. Charakterizácia flavonoidov v rastlinných extraktoch. Test chloridu železitého. V výskume liečivých rastlín v Afrike. Zotavené z vedeckých pracovníkov.com.
- Agyare, C. a kol. (2017). Petroselinum Crispum: Recenzia. Antioxidačná aktivita. V liečivých spartoch a zelenine z Afriky. Zotavené z vedeckých pracovníkov.com.
- Stott, r. (2003). Osud a správanie parazitov v systémoch čistenia odpadových vôd. Chemicky asistovaná sedimentácia. V mikrobiológii vody a odpadových vôd. Zotavené z vedeckých pracovníkov.com.
- Tasker, str.Do. a kol. (2003). Aplikácie koordinačnej chémie. Extrakcia CuIi Z roztokov chloridu. Pri porozumení chémie koordinácie. Zotavené z vedeckých pracovníkov.com.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.

