Cínový chlorid (II)
- 1077
- 144
- Adrián Fajnor
On Cínový chlorid Ii) alebo malý chlorid chemického vzorec SNCL2, Je to biela a kryštalická tuhá zlúčenina, produkt CIN reakcie a koncentrovaný roztok kyseliny chlorovodíkovej: SN (S) + 2HCl (conc) => SNC2(aq) + h2g). Proces jeho syntézy (príprava) spočíva v pridávaní kusov cínu, aby reagoval s kyselinou.
Po pridaní kusov cínu sa dehydratácia a kryštalizácia vykonáva, až kým sa nezíska anorganická soľ. V tejto zlúčenine stratil Tin dva elektróny svojej valenčnej vrstvy za vzniku väzieb s atómami chlóru.
To sa dá lepšie pochopiť, ak sa uvažuje o konfigurácii cínu Valencia (5s25 PX2pa0pz0), z ktorých pár elektrónov zaberá orbitálnu pX je priradený k protónom h+, Aby sa vytvorila diatomická molekula vodíka. To znamená, že je to reakcia redoxného typu.
[TOC]
Vlastnosti plechového chloridu
 Cínový chlorid (ii) dihydrát
Cínový chlorid (ii) dihydrát Odkazy SNCL2 Sú iónové alebo kovalentné typy? Fyzikálne vlastnosti chloridu cín (II) zlikvidujú prvú možnosť. Body fúzie a varu pre túto zlúčeninu sú 247 ° C a 623 ° C, čo svedčí o slabých intermolekulárnych interakciách, bežná skutočnosť pre kovalentné zlúčeniny.
Jeho kryštály sú biele, čo sa premieta do nulovej absorpcie vo viditeľnom spektre.
Konfigurácia Valencia
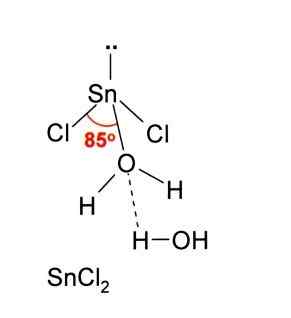
Na obrázku vyššie je ilustrovaná izolovaná minca snick2.
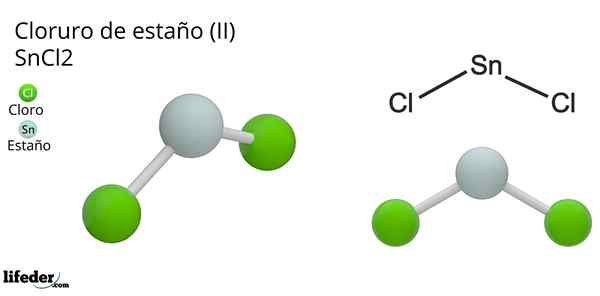
Molekulárna geometria by mala byť plochá, pretože hybridizácia centrálneho atómu je SP2 (3 orbitály SP2 a čistý orbitál, ktorý tvorí kovalentné väzby), ale krútiaci moment bez elektrónov zaberá objem a tlačí atómy chlóru dole, čím sa molekula dáva uhlová geometria.
V plynnej fáze je táto zlúčenina izolovaná, takže neinteraguje s ostatnými molekulami.
Môže vám slúžiť: zubonifikáciaAko strata dvojice elektrónov v orbitálnom pX, Tin sa transformuje na sn ión2+ a jej výsledná elektronická konfigurácia je 5s25 PX0pa0pz0, So všetkými svojimi orbitálmi, ktoré sú k dispozícii na prijatie odkazov od iných druhov.
Ióny- Koordinujú s iónom SN2+ Vznikať cínový chlorid. Elektronická konfigurácia cínu v tejto soli je 5s25 PX2pa2pz0, Byť schopný prijať ďalší pár elektrónov vo svojom voľnom orbitálnom pz.
Napríklad môžete prijať iný Ion Cl-, Tvorba komplexu trigonálnej plochej geometrie (trojuholníková báza pyramídy) a negatívne načítaná [SNCL3]-.
Reaktivita
SNCL2 Má vysokú reaktivitu a trend správať sa ako kyselina Lewis (elektrónový receptor) na dokončenie svojho oktetu Valencia.
Ako aj prijať ión CL-, To isté platí pre vodu, ktorá „hydratuje“ atóm cín, keď je molekula vody spojená priamo s cínom a druhá molekula vody vytvára interakcie vodíkovým mostom s prvým.
Výsledkom je, že SNCL2 Nie je to čisté, ale koordinované s vodou v jej dihydratovanej soli: SNCL2· 2h2Ani.
SNCL2 Je veľmi rozpustný vo vode a polárnych rozpúšťadlách, pretože je to polárna zlúčenina. Jej rozpustnosť vo vode, menšia ako jej hmotnosť, však aktivuje hydrolytickú reakciu (prasknutie molekuly vody), aby sa vytvorila základná a nerozpustná soľ:
SNCL2(aq) + h2Alebo (l) sn (OH) cl (s) + HCl (aq)
Dvojitá šípka naznačuje, že sa stanoví rovnováha, ktorá sa zvýši vľavo (smerom k reagenciám), ak sa koncentrácie HCL zvýšia. Preto riešenia SNCL2 Zamestnanci majú kyslé pH, aby sa predišlo zrážkam nežiaducemu produktu hydrolýzy soli.
Môže vám slúžiť: nukleofil: nukleofilný útok, typy, príklady, nukleofilitaRedukčná aktivita
Reaguje s kyslíkom vzduchu za vzniku chloridu cín (IV) alebo chlorid je:
6 SNCL2(aq) + o2g) + 2h2Alebo (l) => 2sncl4(aq) + 4sn (OH) cl (s)
V tejto reakcii cínu oxiduje tvoriace spojenie s atómom elektronegatívneho kyslíka a zvyšuje počet väzieb s atómami chlóru.
Všeobecne platí, že elektronegatívne atómy halogénov (F, Cl, Br a I) stabilizujú prepojenia zlúčenín SN (IV) a táto skutočnosť vysvetľuje, prečo SNCL2 je redukčné činidlo.
Keď oxiduje a stráca všetky svoje valenčné elektróny, SN ión4+ je konfigurácia 5S05 PX0pa0pz0, Byť dvojicou elektrónov v orbitáli 5S je najťažšie „odobrať“.
Chemická štruktúra cínového chloridu
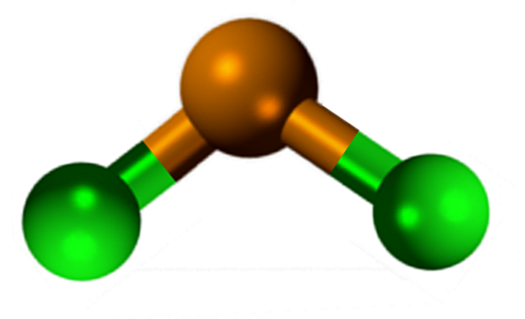 Štruktúra chloridu cínu (II)
Štruktúra chloridu cínu (II) SNCL2 Predstavuje kryštalickú štruktúru ortombického typu, podobne ako v radoch Serruchos, v ktorých sú špičky zubov chloridy.
Každý riadok je reťazec SNCL3 Vytváranie mosta CL s ďalším atómom SN (CL-SN (CL)2-Cl- ···). Dva reťazce, spolu so slabými interakciami typu SN-CL, tvoria vrstvu usporiadania, ktorá sa prekrýva nad inou vrstvou, a tak ďalej až do definovania kryštalickej tuhej látky.
Voľný elektrónový pár 5s2 Spôsobiť skreslenie v štruktúre, pretože zaberá objem (objem elektronického oblaku).
SN môže mať koordinačné číslo rovné deviatich, ktoré je rovnaké ako s deviatimi susedmi, kreslí trigonálny hranol, ktorý sa nachádza v strede geometrickej postavy a CL vo vrcholoch, okrem iného CL umiestneného v každom z nich v každom z nich štvorcové tváre hranolu.
Môže vám slúžiť: HydraceToto je ľahšie pozorovať, ak sa považuje za reťazec, v ktorom smerujú na SN (tmavošedé gule), a traja CL sú spojené s touto formou trojuholníkovej podlahy, zatiaľ čo traja klienti tvoria hornú trojuholníkovú strechu.
Použitie/aplikácie
Pri organickej syntéze sa používa ako redukčné činidlo aromatických nitro zlúčenín (AR-NO2 à ar-nh2). Pretože jej chemická štruktúra je laminárna, zistí, že vo svete katalýzy organických reakcií, okrem toho, že je potenciálnym kandidátom na katalytickú podporu.
Jeho redukčná vlastnosť sa využíva na určenie prítomnosti zlatých zlúčenín, na zakrytie skla striebornými zrkadlami a slúži ako antioxidant.
Tiež vo svojej molekulárnej geometrii trigonálna pyramída (: SNX3- M+) sa používa ako lewisová základňa pre syntézu obrovského počtu zlúčenín (ako je komplex klastra PT3Sn8Cldvadsať, kde je pár bez elektrónov koordinovaný s kyselinou Lewis).
Riziká
SNCL2 Môžete poškodiť biele krvinky. Je korozívny, dráždivý, karcinogénny a má vysoké negatívne vplyvy na druhy, ktoré obývajú morské ekosystémy.
Môže sa rozložiť pri vysokých teplotách a uvoľní škodlivý plyn chlóru. V kontakte s veľmi oxidačnými činidlami spúšťa výbušné reakcie.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. V Prvky skupiny 14 (Štvrté vydanie., p. 329). MC Graw Hill.
- Chemická kniha. (2017). Chemická kniha: Chemicalbook.com
- Publikácia. (2018). Cínový chlorid. PubChem obnovené: pubchem.Ncbi.NLM.NIH.Vláda
- Wikipedia. (2017). Cín (ii) chlorid. Wikipedia sa zotavila: v.Wikipedia.orgán
- F. Hulliger. (1976). Štrukturálna chémia fáz typu vrstvy. P-120,121. D. Readel Publishing Company.

