Štruktúra kyseliny sulfhydrovej (H2S), vlastnosti, použitie, dôležitosť
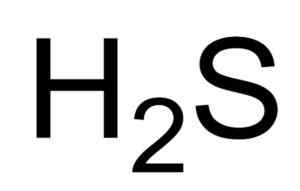
- 2064
- 283
- Ing. Ervín Petruška
On kyselina sulfhydrová o Sulfid vodíka je plyn tvorený spojením atómu (S) a dvoch atómov vodíka (H). Jeho chemický vzorec je H2Siež. Je tiež známy ako sulfidový plyn. Je to bezfarebný plyn, ktorého vôňa je zrejmá v zhnitých vajciach.
Je prítomný v sopkách a sulfuróznych horúcich prameňoch, v zemnom plyne a ropnom rope. Vytvára sa tiež počas anaeróbneho (bez kyslíka) rozkladu rastlinných a živočíšnych organických látok. Vyskytuje sa prirodzene v tele cicavcov prostredníctvom pôsobenia určitých enzýmov na cysteín, neosentičnú aminokyselinu.
 Chemický vzorec kyseliny sulfhydrovej alebo sulfidu vodíka. Saranphong Yimklan [verejná doména]. Zdroj: Wikimedia Commons.
Chemický vzorec kyseliny sulfhydrovej alebo sulfidu vodíka. Saranphong Yimklan [verejná doména]. Zdroj: Wikimedia Commons. Vodné roztoky H2S sú korozívne pre kovy, ako je oceľ. H2S je redukčná zlúčenina, ktorá pri reagovaní s SO2 , Oxiduje elementárnu síru a zároveň sa znižuje2 Tiež do síry.
Napriek tomu, že je to vysoko toxická a smrteľná zlúčenina pre človeka a zvieratá, jeho význam sa už niekoľko rokov študoval v sérii dôležitých procesov v tele.
Reguluje sériu mechanizmov súvisiacich s tvorbou nových krvných ciev a fungovaním srdca.
Chráňte neuróny a premýšľali o svojom konaní proti chorobám ako Parkinson a Alzheimer's.
Kvôli jeho chemickému redukcii môže bojovať proti oxidačným druhom, čím pôsobí proti starnutiu buniek. Z týchto dôvodov sa študuje možnosť výroby liekov, že ak sa dodávajú pacientom.
To by slúžilo na liečbu patológií, ako je ischémia, cukrovka a neurodegeneratívne choroby. Ich mechanizmus konania a ich bezpečnosť sa však musí stále podrobne vyšetrovať.
[TOC]
Štruktúra
H molekula2S je analogický s vodou, to znamená, že sa podobajú svojej forme, pretože vodíny sú umiestnené tvoriace uhol so sírom.
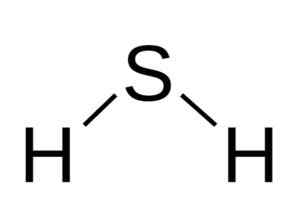 Uhlová štruktúra molekuly kyseliny sulfidovej kyseliny, h2Siež. Bangin [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/]]. Zdroj: Wikimedia Commons.
Uhlová štruktúra molekuly kyseliny sulfidovej kyseliny, h2Siež. Bangin [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/]]. Zdroj: Wikimedia Commons. Síra v h2S má nasledujúcu elektronickú konfiguráciu:
1s2, 2s2 2 P6, 3s2 3p6,
Potom vezmite elektrón každého vodíka, aby ste dokončili svoju valenčnú vrstvu.
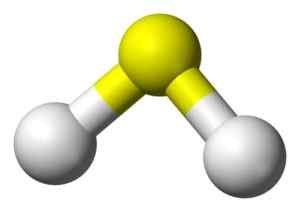 3D štruktúra kyseliny sulfidov. Žltá: Síra. Biely: vodík. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons.
3D štruktúra kyseliny sulfidov. Žltá: Síra. Biely: vodík. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons. Menovanie
- Kyselina sulfhydrová
- Sírovodík
- Hydrid.
Fyzikálne vlastnosti
Fyzický stav
Bezfarebný plyn s veľmi nepríjemným zápachom.
Molekulová hmotnosť
34,08 g/mol.
Bod topenia
-85,60 ° C.
Bod varu
-60,75 ° C.
Hustota
1 1906 g/l.
Rozpustnosť
Stredne rozpustné vo vode: 2,77 objemov v 1 vode pri 20 ° C. Z vodného roztoku sa dá úplne vysťahovať tak, že ho predloží varu.
Chemické vlastnosti
Vo vodnom roztoku
Keď je sulfid vodíka vo vodnom roztoku, je priradený názov kyseliny sulfhydrovej. Je to slabá kyselina. Má dva ionizovateľné protóny:
H2S + h2Alebo ⇔ h3Ani+ + HS-, Klimatizovaťa1 = 8,9 x 10-8
HS- + H2Alebo ⇔ h3Ani+ + Siež2-, KlimatizovaťA2 ∼ 10-14
Prvý protón je ľahko ionizovaný, ako je možné odvodiť z jeho prvej ionizačnej konštanty. Druhý protón je veľmi málo ionizovaný, ale H'ho riešenia2S obsahuje niečo zo síry2-.
Ak H riešenie H2S je vystavený vzduchu, O2 Oxida na sulfidový anión a zrážky síry:
Môže vám slúžiť: oxidy2 s2- + 4 h+ + Ani2 → 2 h2O + 2 s0↓ (1)
V prítomnosti chlóru Cl2, Bromo br2 a jód i2 Vytvára sa zodpovedajúci vodík a síra:
H2S + br2 → 2 HBR + S0↓ (2)
Vodné roztoky H2S sú korozívne, vytvárajú praskanie stresu sulfidom vo vysokých tvrdých oceliach. Korózne výrobky sú železo a sulfid vodíka.
Reakcia kyslíka
H2S reaguje s kyslíkom vzduchu a môžu sa vyskytnúť nasledujúce reakcie:
2 h2S + 3 o2 → 2 h2O + 2 SO2 (3)
2 h2S + O2 → 2 h2O + 2 s0↓ (4)
Reakcia s kovmi
Reaguje s rôznymi kovmi, ktoré sa pohybujú na vodík a tvoria sulfid kovu:
H2S + PB → PBS + H2↑ (5)
Reakcia s oxidom siričitého
V sopečných plynoch sú prítomné H2S a tak2, ktoré reagujú navzájom a vytvára sa pevná síra:
H2S + SO2 → 2 h2O + 3 s0↓ (6)
Rozklad s teplotou
Sulfid vodíka nie je príliš stabilný, ľahko sa rozbije zahrievaním:
H2S → H2↑ + s0↓ (7)
Miesto v prírode
Tento plyn sa prirodzene vyskytuje v sulfidových alebo sírových horúcich prameňoch, v sopečných plynoch, v rope a zemnom plyne.
 Sulfurovaný vodný. '.0 (https: // creativeCommons.Org/licencie/o/3.0)]. Zdroj: Wikimedia Commons.
Sulfurovaný vodný. '.0 (https: // creativeCommons.Org/licencie/o/3.0)]. Zdroj: Wikimedia Commons. Ak olej (alebo plyn) obsahuje významné stopy h2S je údajne „kyslý“, na rozdiel od „sladkého“, čo je vtedy, keď ho neobsahuje.
Malé množstvá H2S v rope alebo plyne sú ekonomicky škodlivé, pretože na jej odstránenie musí byť inštalovaná umývacia elektráreň, aby sa zabránilo korózii a aby sa zvyškový plyn pre domácnosť používal ako palivo ako palivo ako palivo.
Vyskytuje sa vždy, keď sa organická hmota, ktorá obsahuje síru, rozkladá za anaeróbnych podmienok (neprítomnosť vzduchu), ako sú ľudské, zvieratá a rastlinný odpad.
 H emisie2S (modrú zelená farba) na pobreží Namíbie, fotografované NASA. Tieto emisie pochádzajú z organického odpadu. Observatórium Zeme NASA [CC po 2.0 (https: // creativeCommons.Org/licencie/BY/2.0)]. Zdroj: Wikimedia Commons.
H emisie2S (modrú zelená farba) na pobreží Namíbie, fotografované NASA. Tieto emisie pochádzajú z organického odpadu. Observatórium Zeme NASA [CC po 2.0 (https: // creativeCommons.Org/licencie/BY/2.0)]. Zdroj: Wikimedia Commons. Baktérie prítomné v ústach a v gastrointestinálnom trakte ho produkujú z degradovateľných materiálov, ktoré obsahujú zelenina alebo živočíšne bielkoviny.
Jeho charakteristická vôňa spôsobuje varovanie jej prítomnosti v zhnitých vajciach.
H2Vyskytuje sa aj v určitých priemyselných činnostiach, napríklad v ropných rafinériách, koksových pecách, papierových továrňach, ktoré by ste mali a pri spracovaní potravín.
Syntéza v tele cicavcov
H2S endogénny sa môže vyskytnúť v tkanivách cicavcov, medzi týmito ľudskou bytosťou, dvoma cestami, enzymatickými a neinzymatickými.
Nonyenzymatická cesta spočíva v redukcii elementárnej síry0 do h2S cez oxidáciu glukózy:
2 c6H12Ani6 (glukóza) + 6 s0 (Síra) + 3 h2O → 3 c3H6Ani3 + 6 h2S + 3 co2 (8)
Môže vám slúžiť: chlór: História, vlastnosti, štruktúra, riziká, použitiaEnzymatická cesta pozostáva z h h2S z L-cysteínu, ktorý je aminokyselinami syntetizovaný telom. Tento proces je poistený niekoľkými enzýmami, ako je napríklad cysta.
 Kyselina sulfhydrová sa našla v mozgu kráv. Autor: Arttower. Zdroj: Pixabay.
Kyselina sulfhydrová sa našla v mozgu kráv. Autor: Arttower. Zdroj: Pixabay. Získanie v laboratóriu alebo priemyselne
Plynný vodík (H2) a prvky sírou (prvky) nereagujú na normálne teploty prostredia, ale nad nimi sa začnú kombinovať, pričom optimálna teplota je 310 ° C.
Tento proces je napriek tomu príliš pomalý, takže na jeho získanie sa používajú iné metódy.
Sulfidy kovov (ako je sulfid železnice) reagujú s kyselinami (ako je hydrochlorická) v zriedenom roztoku.
FES + 2 HCI → FECL2 + H2S ↑ (9)
Týmto spôsobom sa získa plyn2S, ktoré sa vzhľadom na svoju toxicitu musia bezpečne zbierať.
Priemyselné použitie H2S na výrobu síry
Skladovanie a preprava vo veľkom množstve H2S, ktoré sa oddeľujú od zemného plynu umývaním amínami, je ťažké, takže proces Claus sa používa na jeho premenu na síru.
 V ropných rafinériách je H oddelený2S zemným plynom umytím amínami a potom sa stáva síra. Autor: Satyaprem. Zdroj: Pixabay.
V ropných rafinériách je H oddelený2S zemným plynom umytím amínami a potom sa stáva síra. Autor: Satyaprem. Zdroj: Pixabay. V tomto procese sa vyskytujú dve reakcie. V prvom H2S reaguje s kyslíkom, aby tak poskytol2, Ako je uvedené vyššie (pozri reakciu 3).
Druhým je reakcia katalyzovaná oxidom železa, kde SO2 je redukovaný a h2S oxiduje a tieto dva produkujú síru (pozri reakciu 6).
Týmto spôsobom sa získava síra, ktorá sa dá ľahko skladovať a prepravovať, ako aj pridelená na viacnásobné použitie.
Užitočnosť alebo dôležitosť h2S endogénne v organizme
H2S endogén je ten, ktorý sa prirodzene vyskytuje v organizme ako súčasť normálneho metabolizmu u ľudí, cicavcov a iných živých bytostí.
Napriek svojej dlhoročnej povesti, že je toxický a jedovatý plyn spojený s rozkladom organických látok, niekoľko nedávnych štúdií od roku 2000 do súčasnosti určilo, že H2S endogén je dôležitým regulátorom určitých mechanizmov a procesov v živej bytosti.
H2S predstavuje vysokú lipofilitu alebo afinitu k tukom, takže ľahko prechádza bunkové membrány a prenikajú do všetkých typov buniek.
Kardiovaskulárny systém
U cicavcov kyselina sulfid podporuje alebo reguluje sériu signálov, ktoré regulujú metabolizmus, srdcové funkcie a prežitie buniek.
Má silný účinok na srdce, krvné cievy a cirkulujúce prvky krvi. Moduluje bunkový metabolizmus a mitochondriálne funkcie.
Obhajuje obličky poškodenia spôsobenej ischémiou.
Gastrointestinálny systém
Zohrávať dôležitú úlohu ako ochranný faktor proti poškodeniu žalúdočnej sliznice. Odhaduje sa, že je dôležitým mediátorom gastrointestinálnej motility.
Je pravdepodobné, že sa podieľa na kontrole sekrécie inzulínu.
Centrálny nervový systém
Pôsobí tiež v dôležitých funkciách centrálneho nervového systému a chráni neuróny oxidačného stresu.
 Neuróny sú chránené h2S endogénnym. Autor: Gerd Altmann. Zdroj: Pixabay.
Neuróny sú chránené h2S endogénnym. Autor: Gerd Altmann. Zdroj: Pixabay. Odhaduje sa, že môže chrániť pred neurodegeneratívnymi chorobami, ako je Parkinson's Parkinson, Alzheimerova a Hungintonova choroba.
Zrakový orgán
Chráňte fotoreceptorové bunky pred degeneráciou sietnice vyvolanej svetlom.
Môže vám slúžiť: uhličitan lítium (LI2CO3): štruktúra, vlastnosti, použitiaProti starnutiu
H2S, ktorý je redukčným druhom, sa môže konzumovať rôznymi oxidačnými činidlami cirkulujúcimi v tele. Bojové oxidujúce druhy, ako sú reaktívne druhy kyslíka a reaktívne druhy dusíka v tele.
Obmedzte reakcie voľných radikálov prostredníctvom aktivácie antioxidačných enzýmov, ktoré chránia pred účinkami starnutia.
Liečivý potenciál h2S dodávané exogénne
Biologická dostupnosť H2S endogénny závisí od určitých enzýmov zapojených do biosyntézy cysteínu u cicavcov.
Niektoré štúdie naznačujú, že darca liekovej terapie Don2S môže byť prospešná pre určité patológie.
Napríklad by to mohlo byť užitočné u diabetických pacientov, pretože sa zistilo, že krvné cievy diabetických zvierat sa zlepšujú liečivami, ktoré dodávajú H2S exogénnym.
H2S poskytla exogénne zvyšuje angiogenézu alebo tvorbu krvných ciev, takže by mohla slúžiť na liečbu chronických chorôb ischémie.
Sú navrhnuté lieky, ktoré môžu uvoľniť h2Pomaly, aby ste boli schopní konať priaznivo o rôznych chorobách. Účinnosť, bezpečnosť a mechanizmy ich konania sa však musia stále vyšetriť.
Riziká
H2S je smrteľný jed, ak je vdýchnutý čistý alebo dokonca zriedený 1 časť plynu v 200 častiach vzduchu. Vtáky sú veľmi citlivé na h2A zomrieť dokonca aj pri riedení 1 z 1500 častí vzduchu.
 Kyselina sulfid alebo sulfid vodíka H2S je silný jed. Autor: Openicons. Zdroj: Pixabay.
Kyselina sulfid alebo sulfid vodíka H2S je silný jed. Autor: Openicons. Zdroj: Pixabay. H2S je silný inhibítor určitých enzýmov a oxidačných fosforylačných procesov, čo vedie k zaduseniu buniek. Väčšina ľudí to vníma koncentrácie viac ako 5 ppb (časti na miliardu). Koncentrácie 20-50 ppm (časti na milión) dráždia oči a dýchací trakt.
Vdýchnutie 100 až 250 ppm na niekoľko minút môže generovať nedostatok koordinácie, poruchy pamäte a porúch motorov. Keď je koncentrácia asi 150-200 ppm2Siež. Ak je koncentrácia 500 ppm vdýchnutá po dobu 30 minút, je možné produkovať pľúcny edém a pneumónia.
Koncentrácie viac ako 600 ppm môžu byť smrteľné v priebehu prvých 30 minút, pretože respiračný systém je paralyzovaný. A 800 ppm je koncentrácia, ktorá je pre ľudskú bytosť okamžite smrteľná.
Preto by sa malo vyhnúť tomu, že existujú H Escapes2V laboratóriách, miestnych alebo kdekoľvek alebo situácii.
Je dôležité upozorniť, že sa vyskytuje veľa úmrtí, pretože ľudia vstupujú do priestorov obmedzených na záchranu spolupracovníkov alebo členov rodiny, ktorí sa zrútili kvôli otravám s H2S, tiež ich umiera.
Je to horľavý plyn.
Odkazy
- Panthi, s. a kol. (2016). Fyziologický význam sulfidu vodíka: vznikajúci Potnt neuroprotektor a neuromodulátor. Oxidačná medicína a bunková dlhovekosť. Zväzok 2016. ID článku 9049782. Hyndawi sa zotavil.com.
- Shefa, u. a kol. (2018). Funkcie antioxidantu a bunkového signálu sulfidu vodíka v centrálnom nervovom systéme. Oxidačná medicína a bunková dlhovekosť. Zväzok 2018. ID článku 1873962. Hyndawi sa zotavil.com.
- Tabassum, r. a kol. (2020). Terapeutický význam sulfidu vodíka pri neurodegeneratívnych chorobách spojených s vekom. Neural Regen Res 2020; 15: 653-662. Nrronline sa obnovila.orgán.
- Martelli, a. a kol. (2010). Sulfid vodíka: nová príležitosť na objavovanie liečiv. Recenzie na lekársky výskum. Zväzok 32, vydanie 6. Zdroj: z online knižnice.Mravný.com.
- Wang, m.-J. a kol. (2010). Mechanizmy angiogézy: Úloha sulfidu vodíka. Klinická a experimentálna farmakológia a fyziológia (2010) 37, 764-771. Zdroj: z online knižnice.Mravný.com.
- Dalefield, r. (2017). Dym a iné vdýchnuté toxikonty. Sírovodík. Vo veterinárnej toxikológii pre Austráliu a Nový Zéland. Zotavené z vedeckých pracovníkov.com.
- Selley, R.C. a Sonnenberg, s.Do. (2015). Fyzikálne a chemické vlastnosti ropy. Sírovodík. V prvkoch ropnej geológie (tretie vydanie). Zotavené z vedeckých pracovníkov.com.
- Hocking, m.B. (2005). Kyselina síra a sírová. Konverzia procesu clausu sulfidu vodíka na síru. V príručke chemických technológií a kontroly znečistenia (tretie vydanie). Zotavené z vedeckých pracovníkov.com.
- Lefer, D.J. (2008). Potenciálny význam zmien sulfidu vodíka (H2S) biologická dostupnosť pri cukrovke. British Journal of Pharmacology (2008) 155, 617-619. Zdroj z bpspubs.Online knižnica.Mravný.com.
- Alebo.Siež. Lekárska knižnica. (2019). Sírovodík. Získané z: pubchem.Ncbi.NLM.NIH.Vláda.
- Port, j.Do. a Ibarz, J. (1965). Moderná všeobecná chémia. 7. vydanie. Marín redakcia, s.Do.
- « Pôvod socialistického vzdelávania, charakteristiky, princípy, príklady
- Neoklasická história divadla, charakteristiky, zástupcovia, diela »

