Štruktúra kyseliny dusnej (HNO2), vlastnosti, syntéza

- 3498
- 200
- Denis Škriniar
On kyselina Je to slabá kyselina anorganická, ktorej chemický vzorec je HNO2. Je zásadne vo vodnom roztoku s bledomodrými sfarbeniami. Je veľmi nestabilný a rýchlo sa rozdelí na oxid dusnatého, NO a v kyseline dusičnej, ino3.
Zvyčajne je vo vodnom roztoku vo forme dusitanov. Prirodzene pochádza z atmosféry v dôsledku reakcie oxidu dusnatého s vodou. Tam, konkrétne v troposfére, kyselina dusná zasahuje do regulácie koncentrácie ozónu.
 Roztok dusnej kyseliny v kadičke. Zdroj: K dispozícii nie je žiadny stroj na čítanie stroja. Mad vedec ~ Commonswiki prevzal (na základe nárokov na autorské práva). [Verejná doména]
Roztok dusnej kyseliny v kadičke. Zdroj: K dispozícii nie je žiadny stroj na čítanie stroja. Mad vedec ~ Commonswiki prevzal (na základe nárokov na autorské práva). [Verejná doména] Na hornom obrázku je zobrazený roztok HNO2 kde je možné vidieť charakteristickú svetlo modrú farbu tejto kyseliny. Je syntetizovaný rozpustením dusičného oxidu, n2Ani3, Vo vode. Podobne je to produkt acidifikácie roztokov dusitanov sodného pri nízkych teplotách.
Hno2 Má malé komerčné použitie, pričom sa používa vo forme dusitanu pri zachovaní mäsa. Na druhej strane sa používa pri vypracovaní azoických farbív.
Používa sa spolu s tiosíranom sodným pri liečbe otravy kyanidom sodného. Je to však mutagénne činidlo a predpokladá sa, že môže spôsobiť substitúcie v bázách DNA reťazcov prostredníctvom oxidačnej deaminácie cytozínu a adenínu.
Kyselina dusná má duálne správanie, pretože sa môže správať ako oxidačné činidlo alebo ako redukčné činidlo; to znamená, že sa dá zredukovať na NO alebo N2, oxidovať3.
[TOC]
Štruktúra kyseliny dusnej
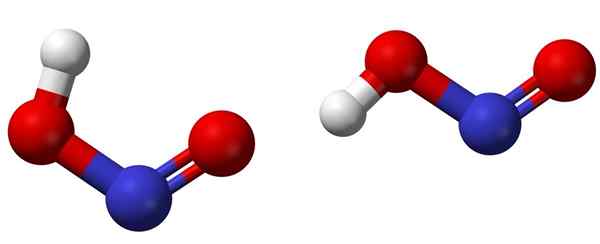 Cis (vľavo) a trans (vpravo) izoméry s príslušnými molekulárnymi štruktúrami HNO2. Zdroj: Ben Mills [verejná doména].
Cis (vľavo) a trans (vpravo) izoméry s príslušnými molekulárnymi štruktúrami HNO2. Zdroj: Ben Mills [verejná doména]. Horný obrázok ukazuje molekulárnu štruktúru kyseliny dusnej pomocou modelu guľôčok a stĺpcov. Atóm dusíka (modrá guľa) sa nachádza v strede štruktúry a vytvára dvojitú väzbu (n = o) a jednoduchý (N-O) s atómami kyslíka (červené gule).
Všimnite si, že atóm vodíka (biela guľa) je spojený s jedným z kyslíka a nie priamo s dusík. Takže, keď to viete, štrukturálny vzorec HNO2 Je to [HO-N = O] alebo [NO (OH)] a neexistuje žiadny taký H-N LINK (ako si môže myslieť chemický vzorec).
Obrazové molekuly zodpovedajú molekulám plynnej fázy; Vo vode sú obklopené molekulami vody, ktoré môžu akceptovať vodíkový ión (slabo) za vzniku iónov nie2- a h3Ani+.
Môže vám slúžiť: kadičkaJeho štruktúry môžu prijať dve formy: CIS alebo trans, nazývané geometrické izoméry. V izoméri CIS je atóm H zatienený susedným atómom kyslíka; Zatiaľ čo v trans izoméri sa obidve nachádzajú v anti -opositových pozíciách.
V izoméri CIS je pravdepodobné tvorba intramolekulárneho vodíka (OH-NO), ktorá môže dovážať intermolekulárne (ONOH-OROH).
Vlastnosti
Chemické názvy
-Kyselina
-Kyselina dioxonitrová (III)
-Hydroxid nitrozile
-Hydroxideoxidonitrogén (systematický názov IUPAC)
Fyzický popis
Bledomodrá kvapalina, zodpovedajúca roztoku dusitanu.
Molekulová hmotnosť
47,013 g/mol.
Disociačná konštanta
Je to slabá kyselina. Jeho PKA je 3,35 až 25 ° C.
Bod topenia
Je známy iba v roztoku. Preto nie je možné vypočítať váš bod topenia, ani vaše kryštály nemožno izolovať.
Bod varu
Neexistujúce čisté, ale vo vode, merania tejto vlastnosti nie sú presné. Na jednej strane záleží na koncentrácii HNO2, A na druhej strane, jeho otepľovanie vytvára rozklad. Preto nie je uvedený presný bod varu.
Tvorba predaja
Rozpustné vodné dusičnany s Li+, Nat+, Klimatizovať+, Ac2+, Pán2+, BA2+. Ale nevytvárajte soli s všestrannými katiónmi, ako napríklad:3+ a/alebo byť2+ (Kvôli svojej vysokej hustote zaťaženia). Je schopný vytvárať stabilné estery s alkoholmi.
Oheň
Je horľavý pre chemické reakcie. Môže explodovať kontaktom s trichloridom fosforu.
Rozklad
Je to veľmi nestabilná zlúčenina a vo vodnom roztoku sa rozkladá v kyseline dusičného oxidu a kyseliny dusičnej:
2 hno2 => Nie2 + No +h2Ani
4 Hno2 => 2 hno3 + N2Alebo +h2Ani
Redukčné činidlo
Kyselina dusná vo vodnom roztoku je uvedená vo forme dusitanových iónov, nie2-, ktoré zažívajú niekoľko redukčných reakcií.
Reaguje s iónmi i- A viera2+, vo forme dusitanu draselného, za vzniku oxidu dusnatého:
2 Kno2 + Ki +h2SW4 => I2 + 2 Nie +2 h2Alebo +k2SW2
Dusičnan draselný v prítomnosti cínových iónov sa redukuje na tvorbu oxidu dusného:
Pokaziť sa2 + 6 HCl +2 SNCL2 => 2 SNCL4 + N2O +3 h2O +2 kcl
Môže vám slúžiť: beryl hydroxid (be (oh) 2)Dusičnan draselný je redukovaný Zn v alkalickom prostredí a vytvára amoniak:
5 h2O +Kno2 + 3 zn => nh3 + Koh +3 Zn (OH)2
Oxidačný činiteľ
Okrem toho, že je redukčným činidlom, môže kyselina dusná zasahovať do oxidačných procesov. Napríklad: oxidujte na sulfid vodíka a stáva sa oxidom dusnatého alebo amoniaku, v závislosti od kyslosti média, v ktorom dôjde k reakcii.
2 hno2 + H2S => S +2 nie +2 h2Ani
Hned2 + 3 h2S => s +nh3 + 2 h2Ani
Kyselina dusná, v kyslom pH médiu, môže oxidovať jodidový ión na jód.
Hned2 + Jo- + 6 h+ => 3 i2 + NH3 + 2 h2Ani
Môžete tiež pôsobiť ako redukčný agent konajúci na Cu2+, spôsobujúca kyselina dusičná.
Menovanie
Do HNO2 Môžete uviesť ďalšie mená, ktoré závisia od typu nomenklatúry. Kyselina dusná zodpovedá tradičnej nomenklatúre; Kyselina dioxonitrová (III), do nomenklatúry zásob; a dioxonitrát (iii) vodíka, systematické.
Syntéza
Kyselina dusná sa môže syntetizovať rozpustením trioxidu dusičného vo vode:
N2Ani3 + H2O => 2 hno2
Ďalším spôsobom prípravy je reakcia dusitanu sodného, nano3, s minerálnymi kyselinami; ako je kyselina hydrochlorovodíková a kyselina bromhyterová. Reakcia sa vykonáva pri nízkej teplote a kyselina dusná sa konzumuje in situ.
Starší brat3 + H+ => Hno2 + Nat+
H+ Prichádza buď z HCL alebo HBR.
Riziká
Vzhľadom na svoje chemické vlastnosti a charakteristiky existuje len málo informácií o priamych toxických účinkoch HNO2. Možno, že niektoré škodlivé účinky, ktoré sa predpokladajú, sú vyvolané touto zlúčeninou, sú skutočne spôsobené kyselinou dusičnou, ktorá sa môže vyskytnúť rozkladom kyseliny dusnej.
Zdôrazňuje sa, že HNO2 Môže mať škodlivé účinky na dýchacie cesty a byť schopný vyvolať príznaky podráždenia u astmatických pacientov.
Vo forme dusitanu sodného je redukovaný deoxyhemoglobínom, ktorý produkuje oxid dusnatý. Je to silný vazodilatátor, ktorý vytvára relaxáciu vaskulárnych hladkých svalov, odhaduje sa u ľudí dávka LD50 35 mg/kg na ústnu spotrebu.
Toxicita dusitana sodného sa prejavuje kardiovaskulárnym kolapsom, po ktorom nasleduje závažná hypotenzia v dôsledku vazodilatátora účinku oxidu dusnatého, produkovaného z dusitanu.
Oxid dusíka, nie2, Prítomný v kontaminovanom vzduchu (smog), za určitých podmienok môže spôsobiť kyselinu dusnú; ktoré zase môžu reagovať s amínmi za vzniku nitrozamínu, gama karcinogénnych zlúčenín.
Môže vám slúžiť: oxid striebra (AG2O)Podobná reakcia dochádza k dymu cigariet. Zistili sa nitrosamínové zvyšky dodržiavané do vnútornej výstelky fajčiarskych vozidiel.
Žiadosti
Výroba predaja diazónie
Kyselina dusná sa používa v priemysle pri výrobe diazóniových solí prostredníctvom reakcie s aromatickými amínmi a fenolmi.
Hned2 + Rnah2 + H+ => RNA = NAR +H2Ani
Diazonium soli sa používajú v reakciách organických syntéz; Napríklad pri reakcii Sandmeyer. V tejto reakcii dochádza k nahradeniu aminoskupiny (h2N-), v primárnom aromatickom amíne, podľa skupín CL-, Br- a CN-. Na získanie týchto aromatických výrobkov sú potrebné Coupro soli.
Diazonium soli môžu tvoriť brilantné strešné zlúčeniny, ktoré sa používajú ako farbivá a tiež slúžia ako kvalitatívny test na detekciu prítomnosti aromatických amínov.
Eliminácia azida sodného
Kyselina dusná sa používa na odstránenie azidu sodného3), čo je potenciálne nebezpečné pre jeho tendenciu využívať.
2 nan3 + 2 hno2 => 3 n2 + 2 Nie +2 NaOH
Syntéza oximov
Kyselina dusná môže reagovať s ketónovými skupinami za vzniku oximov. Môžu sa oxidovať za vzniku karboxilov alebo redukovanej kyseliny, aby spôsobili amín.
Tento proces sa používa pri komerčnej príprave kyseliny adipovej, monoméru používaného pri výrobe nylonu. Zasahuje tiež do výroby polyuretánu a jeho esterov sú plastifikátory, hlavne v PVC.
Pod jeho fyziologickou formou
Kyselina dusná, vo forme dusitanu sodného, sa používa pri liečbe a zachovaní mäsa; Pretože bráni bakteriálnemu rastu a je schopný reagovať s myoglobínom, čím sa vytvára tmavočervená farba, vďaka ktorej je mäso atraktívnejšou pre spotrebu.
Rovnaká soľ sa používa spolu s tiosíranom sodným, pri intravenóznom ošetrení otravy kyanidom sodného.
Odkazy
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. Amín. (10th Vydanie.). Wiley Plus.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Publikácia. (2019). Kyselina. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Softvérky. (2019). Kyselina. Obnovené z: softschools.com
- Wikipedia. (2019). Kyselina. Zdroj: In.Wikipedia.orgán
- Kráľovská spoločnosť chémie. (2015). Kyselina. Obnovený z: ChemSpider.com
- Encyklopédia New World. (2015). Kyselina. Získané z: Novýworldyclopedia.orgán
- Drogová banka. (2019). Kyselina. Získané z: drogankank.Ac
- Chemická formulácia. (2018). Hned2. Získané z: Quimica Formulation.com
- « Údaje alebo ukazovatele, ktoré hovoria o vzdelávacích pokrokoch v krajine
- Vlastnosti alkyl halogenuros, získanie, príklady »

