Vlastnosti alkyl halogenuros, získanie, príklady
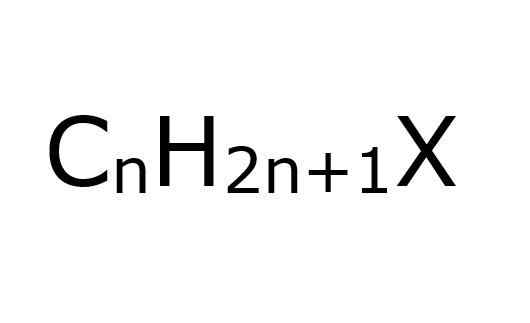
- 4822
- 1078
- Alan Milota
Ten alkyl halogenuróz Sú to organické zlúčeniny, v ktorých atóm uhlíka s hybridizáciou SP3 Halogén je kovalentne spojený (F, Cl, Br, I). Z iného hľadiska je vhodné, aby sa zjednodušilo, predpokladať, že sú haloalcanos; To sú tie, ktoré boli nahradené niektorými atómami h halogénov.
Ako už názov napovedá, atómy halogénu musia byť spojené s alquilitickými skupinami, R, ktoré sa majú považovať za tento typ halogenidu; Aj keď sú štrukturálne nahradené alebo rozvetvené a majú aromatické krúžky a stále sú naďalej alkyl halogenid.
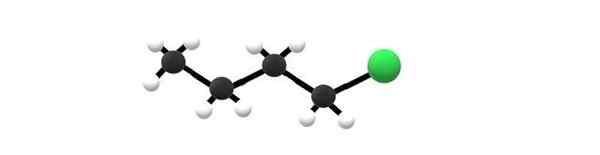 1-chlórbutano molekula, príklad alkyl halogenid. Zdroj: Gabriel Bolívar.
1-chlórbutano molekula, príklad alkyl halogenid. Zdroj: Gabriel Bolívar. Hore máte molekulu 1-chlórbutano, ktorá zodpovedá jednému z najjednoduchších alkyl halogenidov. Je zrejmé, že všetky ich uhlíky majú jednoduché putá a tiež majú hybridizáciu SP3. Zelená guľa, zodpovedajúca atómu CL, je preto spojená so kostrou odvodenou z butánovej alkáne.
Príklady ešte jednoduchšie ako 1-chlórbutano sú tie, ktoré sú odvodené z metánového plynu: najmenší uhľovodík zo všetkých.
Z jeho molekuly Cho4 Atómy H môžete nahradiť, povedzme, jód. Ak sa nahradí H, bude CH3I (yodomethan alebo metyljodid). Keď sa vymenia dve h, bude CH2Jo2 (Diyodomethán alebo metylén jodid). Nasledoval som a nakoniec nahradím všetky H, ktoré dávam Chi3 (jodoforma) a CI4 (Carbon Tetrayoduro).
Prenájom halogenúrov sa vyznačuje tým, že je veľmi reaktívny a má najkrajšie elektronegatívne atómy periodickej tabuľky, je intuitatívne, že prostredníctvom mechanizmov symfíny uplatňujú vplyv na biologické matice.
[TOC]
Vlastnosti alkyl halogenuróz
Vlastnosti tejto rodiny zlúčenín závisia od jej molekulárnych štruktúr. Avšak v porovnaní s tými, ktoré ich alkánovia, pozoruhodné rozdiely spôsobené jednoduchou skutočnosťou, že existujú odkazy C-X (x = atóm halogénu).
To znamená, že odkazy C-X sú zodpovedné za akýkoľvek rozdiel alebo podobnosť medzi jedným alebo viacerými alkyl halogenurózami.
Na začiatok sú odkazy C-H takmer apolárne, vzhľadom na nízky rozdielny rozdiel v elektronegativite medzi C a H; Namiesto toho majú odkazy C-X trvalý dipólový moment, pretože halogény sú viac elektronegatívne ako uhlík (najmä fluór).
Na druhej strane, niektoré halogény sú ľahké (F a Cl), zatiaľ čo iné sú ťažké (BR a I). Jeho atómové masy tiež plesnia rozdiely v rámci spojení C-X; A zase priamo vo vlastnostiach halogenidu.
Preto sa pridanie halogénov do uhľovodíka rovná zvýšeniu jeho polarity a molekulárnej hmoty; Je to rovnaké, aby bol menej prchavý (do istej miery), menej horľavým a zvýšil jeho varné alebo fúzne body.
Body varu a fúzie
Vyššie uvedené je znázornené, v rastúcom poradí, veľkosť, a teda hmotnosť rôznych halogénov:
F < Cl < Br < I
Potom sa očakáva, že alkyl halogenidy obsahujúce atómy F sú ľahšie ako tí, ktorí majú atómy BR alebo i.
Napríklad niektoré halogenuros odvodené z metánu sa berú do úvahy:
Chvály3F < CH3Cl < CH3Br < CH3Jo
Chvály2F2 < CH2Cl2 < CH2Br2 < CH2Jo2
A tak ďalej pre ostatné deriváty produkt vyššieho stupňa halogenácie. Upozorňujeme, že objednávka je udržiavaná: fluór halogenuros je ľahší ako jód. Nielen to, ale aj jeho body varu a fúzie sa tiež poslúchajú; RF varte pri nižších teplotách ako RI (r = Cho3, za tento prípad).
Môže vám slúžiť: aromatická elektrofilná substitúcia: mechanizmus a príkladyPodobne sú všetky tieto tekutiny bezfarebné, pretože vo svojich väzbách C-X nemôžu elektróny absorbovať alebo uvoľňovať fotóny, aby cestovali inú hladinu energie. Avšak, ako sa stávajú ťažšími, môžu kryštalizovať a vykazovať farby (ako to robí jód, chi3).
Polarita
Odkazy C-X sa líšia od polarity, ale v opačnom poradí vyššie:
C-F> C-Cl> C-BR> C-I
Preto sú odkazy C-F polárnejšie ako odkazy C-I. RF halogenuros, ktorý je viac polárny. Medzitým sú v RBR alebo RI halogenuros ich dipólové momenty slabšie a interakcie riadené londýnskymi disperznými silami získavajú väčšiu silu.
Roztoková energia
Pretože alkyl halogenidy sú viac polárne ako alkány, z ktorých odvodzujú, zvyšujú svoju schopnosť rozpustiť väčší počet organických zlúčenín. Z tohto dôvodu majú tendenciu byť lepšími rozpúšťadlami; To však neznamená, že môžu nahradiť alkány vo všetkých aplikáciách.
Existujú technické, ekonomické, ekologické a výkonnostné kritériá, ktoré uprednostňujú halogénované rozpúšťadlo pred alkánom.
Menovanie
Existujú dva spôsoby, ako pomenovať alkyl halogenid: pod jeho spoločným názvom alebo podľa jeho systematického názvu (IUPAC). Bežné názvy sa zvyčajne používajú, keď je RX jednoduchý:
CHCL3
Chlorofor: Bežné meno
Metyl alebo trichlórmetán trichlorid: názov IUPAC.
Ale systematické názvy sú preferované (a jediná možnosť), keď majú rozvetvené štruktúry. Je iróniou, že bežné názvy sú opäť užitočné, keď sú štruktúry príliš komplikované (napríklad tie, ktoré budú vidieť v poslednej časti).
Pravidlá na vymenovanie zlúčeniny podľa systému IUPAC sú rovnaké ako v prípade alkoholov: je identifikovaný hlavný reťazec, ktorý je najdlhší alebo najviac rozvetvený. Potom sú karbóny uvedené na konci najbližšie k substituentom alebo dôsledkom, pomenovanie abecedného poriadku.
Príklad
Na ilustráciu máte nasledujúci príklad:
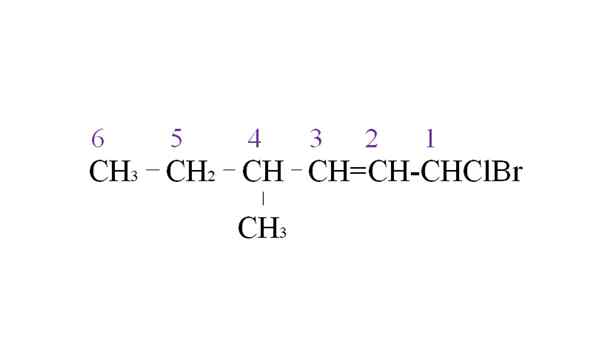 Prenajmite halogenid ako príklad nomenklatúry. Zdroj: Gabriel Bolívar.
Prenajmite halogenid ako príklad nomenklatúry. Zdroj: Gabriel Bolívar. Prvou vetvou je metylová skupina v C-4; Ale mať dvojitú väzbu Túto skoršiu prioritu pred pravidlom vyhlásený. Z tohto dôvodu je najdlhší reťazec uvedený sprava, na čele s atómom uhlíka spojeného s dvoma halogénmi: CL a BR.
Pri vymenovaní sú substituenty pomenované v abecednom poradí:
1-bróm-1-CLOR-4-metyl-2-hexen.
Získanie
Na získanie alkyl halogenidov sa musia molekuly podrobiť halogenačnému procesu; to znamená začleniť atómy halogénu do svojich štruktúr, najmä do atómu do uhlíka SP A3.
Existujú dve metódy na ich získanie alebo syntetizáciu: ultrafialovým žiarením prostredníctvom mechanizmu voľného radikálu alebo pridaním hydracestov alebo halogénov.
Halogenácia so svetlom alebo ultrafialovým žiarením
Prvý, najmenej primeraný as najhoršími výnosmi, spočíva v ožarovaní alkánov s ultrafialovým žiarením (HV) V prítomnosti halogénu. Napríklad sú zobrazené rovnice chlorácie metánu:
Chvály4 + Cl2 => Ch3CL + HCI (pod ultrafialovým svetlom)
Chvály3Cl + cl2 => Ch2Cl2 + Hcl
Chvály2Cl2 + Cl2 => Chcl3 + Hcl
CHCL3 + Cl2 => CCL4 + Hcl
Štyri zlúčeniny (ch3CL, ch2Cl2, CHCL3 a CCL4) Sú tvorené, a preto existuje zmes, ktorá môže byť podrobená frakčnej destilácii. Táto metóda však nie je príliš praktická a uprednostňuje sa, aby sa uchýlila k organickej syntéze.
Môže vám slúžiť: kyselina fenylactová: štruktúra, vlastnosti, použitia, efektyĎalším príkladom je príklad bromácie n-hexánu:
Chvály3Chvály2Chvály2Chvály2Chvály2Chvály3 + Br2 => Ch3(Br) chch2Chvály2Chvály2Chvály3 + HBR
V tejto reakcii sa opäť používa svetlo alebo ultrafialové žiarenie na zvýhodnenie tvorby voľných radikálov. Bromín, ako je intenzívna červená tekutina, sa sfarbuje, keď reaguje, a tak pozoruje červenú až farebnú farbu, keď sa 2-brómxan.
Pridanie hydracestov alebo halogénov do alkénov
Druhým spôsobom získania alkyl halogenuros je liečba alkoholov (ROH) alebo alkénov (r2C = cr2) S hydráciou. Hydrakidy majú všeobecný vzorec HX (HF, HCL, HBR a HI). Príklad sa zobrazí s použitím etanolu pre každého z nich:
Chvály3Chvály2OH + HF => CH3Chvály2F + h2Ani
Chvály3Chvály2OH + HCL => CH3Chvály2CL + H2Ani
Chvály3Chvály2OH + HBR => CH3Chvály2Br + h2Ani
Chvály3Chvály2OH + HI => Cho3Chvály2I + h2Ani
Alkény môžu tiež pridať molekuly HX do svojich dvojitých väzieb, čím tvoria sekundárne alkyl halogenurózy.
Chvály2= CH-CH3 + HBR => BRCH2-Chvály2-Chvály3 + Chvály3-CHBR-CH3
Produkt BRCH2-Chvály2-Chvály3 Je to 1-brómpropano a cho3-CHBR-CH3 2-Bromopropan. Druhým je väčšinový produkt, pretože je ten, ktorý má najväčšiu stabilitu, zatiaľ čo prvý sa vyrába v menšej miere, pretože je nestabilnejší. Je to preto, že Cho3Chmrch3 Je to sekundárny alkyl halogenid.
Veľmi podobné sa vyskytuje, keď sa k alkénu pridáva, je molekula x2:
Chvály2= CH-CH3 + Br2 => BRCH2-CHBR-CH3
Získa sa však alkyl halogenid s dvoma atómami brómu spojených so susednými uhlíkmi; susedstvo alkyl halogenid. Keby sa na druhej strane vzali dva bomo spojené s rovnakým uhlíkom, existoval by geminálny alkyl halogenid, ako je nasledujúce:
Br2CH-CH2-Chvály3
Reakcie
Nukleofilná náhrada
Reaktivity alkyl halogenidov sú v krehkosti alebo rezistencii spojenia C-X. Čím ťažší je halogén, tým slabší bude väzba, a preto sa ľahšie zlomí. V chemických reakčných spojeniach sú rozbité a vytvárajú sa nové; Odkazy C-X sú rozbité, aby sa vytvorili odkaz C-G (g = nová skupina).
Vhodnejšie povedané, X pôsobí ako odchádzajúca skupina a G ako prichádzajúca skupina v reakcii Nukleofilná náhrada. Prečo k tejto reakcii dochádza? Pretože x, je viac elektronegatívom ako uhlík, „ukradne“ elektronickú hustotu a zanecháva deficit elektrónov, ktorá sa prekladá ako pozitívne čiastočné zaťaženie:
CΔ+-XΔ-
Ak je okolo okolia negatívny druh (: g-) alebo neutrálne s dvojicou dostupných elektrónov (: g), ktoré sú schopné vytvoriť stabilnejší C-G odkaz, X sa skončí nahradeným g. Vyššie uvedené môže byť reprezentované s nasledujúcou chemickou rovnicou:
RX +: G- => Rg + x-
Čím slabší je spojenie C-X alebo R-X, tým väčšia je jeho reaktivita alebo tendencia nahradiť Nukleofilné činidlo (alebo nukleofil) g; to znamená, milovníci jadier alebo pozitívnych nábojov.
Príklady
Nižšie je uvedená séria všeobecných rovníc pre nukleofilné substitúcie, ktoré môžu trpieť alkyl halogenidmi:
RX + OH- => Roh + x- (Alkoholy)
+ Alebo'- => Ror' (Ethers, Syntéza Williamsona)
+ Jo- => Ri (alkyl yoduros)
+ CN- => Rcn (nitrilos)
+ R'Coo- => RCoor '(estery)
+ NH3 => Rnh2 (Amíny)
+ P (C6H5)3 => Rp (c6H5)3+ X- (Fosfónne soli)
+ Sh- => Rsh (tioles)
Môže vám slúžiť: etapy chémieZ týchto príkladov je možné podozrenie na hodnotné alkyl halogenidy pre organickú syntézu. Jednou z mnohých substitúcií, ktoré chýbali, je reagovanie Friedel Crafts, ktorá sa používala na „prenájom“ aromatických krúžkov:
RX + ARH + ALCL3 => Rra
V tejto reakcii je H aromatického kruhu nahradený skupinou R -od RX.
Vylúčenie
Prenájom halogenidov môže uvoľňovať molekuly HX eliminačnou reakciou; Konkrétne dehydrohalogentácia:
R2CH-CXR2 + Oh- => R2C = cr2 + Hx
Hovorí sa, že k dehydrohalogenácii dochádza, pretože H a X sa stratia v rovnakej molekule HX.
Syntéza Grignard Reagent
Prenájom halogenidov môže reagovať s určitými kovmi tvoriacimi Grignardovo činidlo, ktoré sa používajú na pridávanie skupín R do iných molekúl. Všeobecná rovnica jeho syntézy je nasledovná:
Rx + mg => rmgx
Príklady
V celých častiach už bolo spomenutých niekoľko príkladov alkyl halogenurí. Niektoré ďalšie, jednoduché, sú:
-Etylchlorid, chlorid3Chvály2Cl
-Izopropil fluóruro, (ch3)2Chvály2F
-2-metyl-3-chlóropentano, chlór, chlór3-Chváli3) -Chcl -ch2Chvály3
-Secbutilo Yoduro, Ch3Chvály2Chvály2I-CH3
-3-Bromo-6-Eriodheptano, CH3-Chvály2-CHBR-CH2-Chvály2-Chvály2Jo
-3.4-Dibromo-1-penteno, ch3-CHBR-CHBR-ch = chrk2
Žiadosti
Solventný
V predchádzajúcich oddieloch sa urobilo zmienka o kapacite rozpúšťadla alkyl halogenidov. Z tejto nehnuteľnosti ich priemysel využil ako čistiaci prostriedok, buď pre textilné hmoty, elektronické komponenty alebo odstraňovanie lakových škvŕn.
Používajú sa tiež ako rozpúšťadlá obrazov alebo organické alebo mastné vzorky pre nespočetné typy analytických testov.
Organická syntéza
Prenájom halogenúrov je veľmi užitočný pre „prenájom“ aromatických krúžkov, pričom slúži ako východiskový zdroj pre syntézu prakticky všetkých ostatných rodín organických zlúčenín. Synteticky sa RX považuje za zdroj skupín alebo reťazcov R, ktorý je možné požadovať na začlenenie vysoko aromatických zlúčenín.
Farmaceutický priemysel
Na začiatku sa spomenulo, že atómy halogénu interagujú s biologickými matkami, takže v našich organizmoch nemôžu zostať bez povšimnutia bez toho, aby vytvorili zmenu, pozitívne alebo negatívne. Ak liek má na telo pozitívny účinok, ktorý má atóm halogénu, ktorý sa môže alebo nemusí zvýšiť.
Takže, ak je X priamo spojený s uhlíkom s hybridizáciou SP3, bude existovať alkyl halogenid a nie halogénovaný derivát. Niektoré z takýchto halogenurí sú uvedené nižšie v nasledujúcej sérii obrázkov:
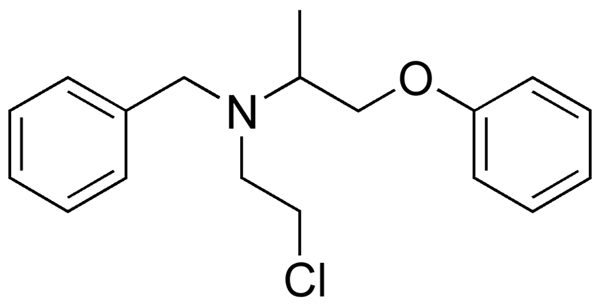 Fenoxibenzamín, liek používaný na kombináciu krvného tlaku u pacientov s feochromocytómom. Zdroj: Utennt: Mark Pea [verejná doména].
Fenoxibenzamín, liek používaný na kombináciu krvného tlaku u pacientov s feochromocytómom. Zdroj: Utennt: Mark Pea [verejná doména].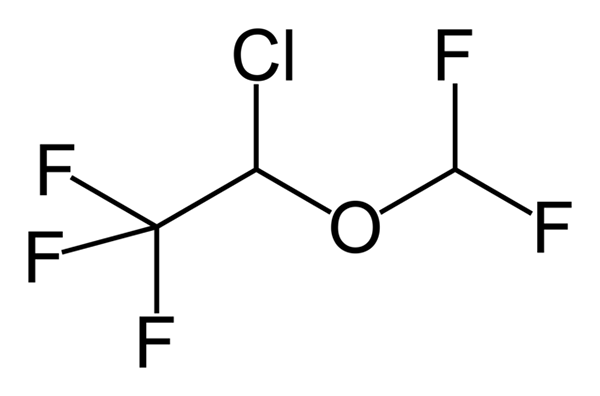 Isoflurano, anestetikum vdýchnutia. Zdroj: Benjah-Bmm27 [verejná doména].
Isoflurano, anestetikum vdýchnutia. Zdroj: Benjah-Bmm27 [verejná doména].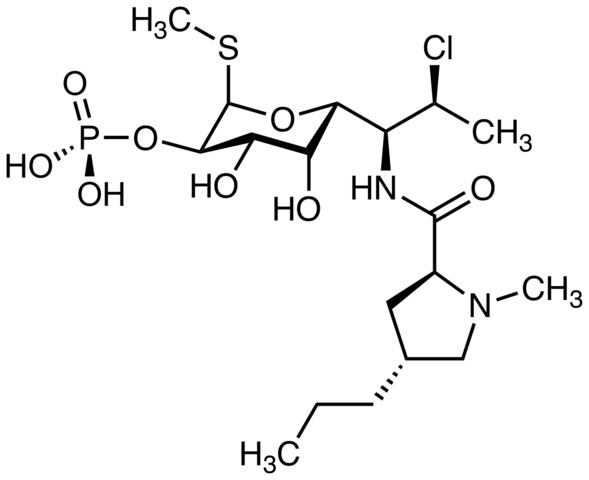 Clindamycín, antibiotikum. Zdroj: M Mitcheltrate [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)].
Clindamycín, antibiotikum. Zdroj: M Mitcheltrate [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)].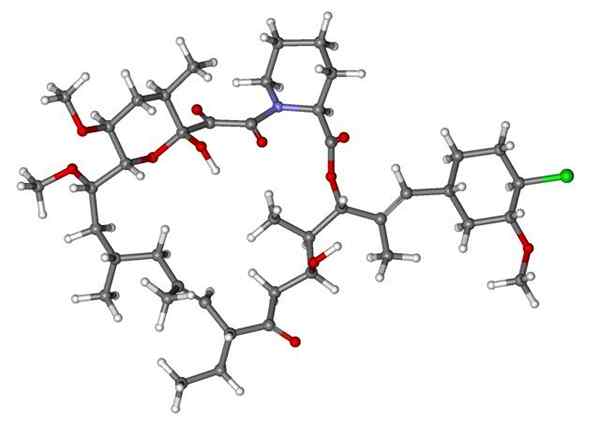 Pimecrolimus, ktorý sa používa na liečbu atopickej dermatitídy. Môžete nájsť atóm chlóru? Zdroj: Marinavladivok [CC0].
Pimecrolimus, ktorý sa používa na liečbu atopickej dermatitídy. Môžete nájsť atóm chlóru? Zdroj: Marinavladivok [CC0]. Halomon, možné protinámorálne činidlo a alkyl halogenid morských rias rias Portieria Hornemannii, prírodný zdroj. Zdroj: Jü [verejná doména]
Halomon, možné protinámorálne činidlo a alkyl halogenid morských rias rias Portieria Hornemannii, prírodný zdroj. Zdroj: Jü [verejná doména]
Všimnite si, že v týchto piatich liekoch existuje aspoň jeden odkaz typu Cho2-X alebo CH-X; To znamená, halogén je spojený s carbónom SP3.
Chladivo
Slávne chladivo Freón-12 (CHCIF2), Rovnako ako iné fluóralcanos alebo hydrofluórky, v tejto funkcii nahradili amoniak a chlórfluórokarbóny (CFC), pretože dokonca aj keď boli neo -prchavými alebo toxickými látkami, zničili ozónovú vrstvu; Zatiaľ čo Freón-12, pretože je reaktívnejší, je zničený pred dosiahnutím takýchto nadmorských výšok.
Odkazy
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Clark Jim. (14. júla 2016). Použitie alkylových halidov. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Gál, b., Bucher, C., & Burns, n. Z. (2016). Chirálne alkyl halogenidy: nedostatočne premyslené motívy v medicíne. Morské lieky, 14 (11), 206. Doi: 10.3390/MD14110206
- Alkylhalogenidy. Zdroj: Chemed.Chem.Purdue.Edu
- Patkar Prachi. (16. júla 2017). Všetko o alkyl halogenidoch: vlastnosti, použitia a oveľa viac. Vedecká štruktúra. Obnovené z: ScienceStruck.com
- R. odoslať. (2016). Alkylhalogenidy. Obnovené z: hyperfyziky.Fytrický.Gsu.Edu
- Learning Guide pre kapitolu 9 - Alkyl Halogides I. Získané z: kaktusu.Drixie.Edu
- Otázka.Do. Eduardo Vega barrios. (s.F.). Prenájom halogenuros: Vlastnosti, použitia a aplikácie. [PDF. Obnovené z: cvonline.Uaeh.Edu.mx
- « Štruktúra kyseliny dusnej (HNO2), vlastnosti, syntéza
- Štruktúra bromidu lítium, vlastnosti, použitia, riziká »

