Štruktúra kyseliny uhličitám (H2CO3), vlastnosti, syntéza, použitie

- 5071
- 486
- Tomáš Mydlo
On kyselina uhličitá Je to anorganická zlúčenina, hoci existujú tí, ktorí diskutujú o tom, že je skutočne organická, ktorej chemický vzorec je H2Co3. Je to preto diprotická kyselina, schopná darovať dva H ióny+ do vodného prostredia, aby ste vytvorili dve molekulárne katióny h3Ani+. Od neho vznikajú dobre známe hydrogenuhličitan (HCO3-) a uhličitan (CO32-).
Táto zvláštna kyselina, jednoduchá, ale zároveň zapojená do systémov, v ktorých sa mnohé druhy zúčastňujú na rovnováhe kvapaliny a varu, sa tvorí z dvoch základných anorganických molekúl: voda a oxid uhličitý. Prítomnosť CO2 Nezvarené sa vždy pozoruje, že vo vode je bublina, ktorá stúpne na povrch.
 Sklo s splyňovanou vodou, jeden z najbežnejších nápojov obsahujúcich kyselinu uhličitú. Zdroj: pxhere.
Sklo s splyňovanou vodou, jeden z najbežnejších nápojov obsahujúcich kyselinu uhličitú. Zdroj: pxhere. Tento jav sa pravidelne vyskytuje v nealkoholických nápojoch a sýtenej vode.
V prípade sýtenej alebo splynenej vody (vynikajúci obraz) sa takéto množstvo rozpustilo2 že váš tlak pary je viac ako dvojitý atmosférický tlak. Odhalením, rozdiel v tlaku vo fľaši a exteriér znižuje rozpustnosť CO2, Takže sa objavia bubliny, ktoré nakoniec uniknú z tekutiny.
V menšej miere sa to isté stane v akejkoľvek množstve čerstvej alebo slanej vody: keď ich zahrievajú, uvoľnia svoj rozpustený obsah v CO2.
CO2 Nie je to len rozpustené, ale trpí aj transformácie v molekule, ktoré z neho robia H2Co3; Kyselina, ktorá má veľmi malý život, ale dosť na to, aby označila mezúvateľnú zmenu v pH svojho vodného prostredia rozpúšťadla a tiež generuje jedinečný tlmivý systém uhličitanového tlmivého roztoku.
[TOC]
Štruktúra
Molekula
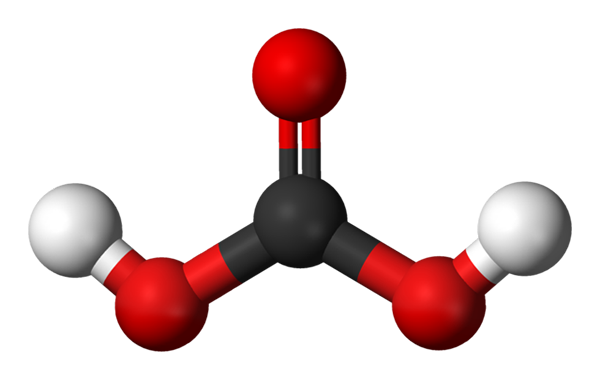 Molekula kyseliny uhličitám predstavovaná s guľovými a stĺpcovými modelmi. Zdroj: Jynto a Ben Mills cez Wikipedia.
Molekula kyseliny uhličitám predstavovaná s guľovými a stĺpcovými modelmi. Zdroj: Jynto a Ben Mills cez Wikipedia. Hore máme molekulu H2Co3, zastúpené s guľami a tyčami. Červené gule zodpovedajú atómom kyslíka, atómom čiernej k uhlíkovi a atómami bieleho vodíka.
Všimnite si, že od obrázka môžete pre túto kyselinu napísať ďalší platný vzorec: CO (OH)2, kde sa Co stáva karbonylovou skupinou, C = o, spojená s dvoma hydroxylovými skupinami, OH. Ak existujú dve skupiny OH, ktoré sú schopné darovať svoje atómy vodíka, teraz sa chápe, odkiaľ pochádzajú H -ióny+ Vydané uprostred.
 Molekulárna štruktúra kyseliny uhličitej.
Molekulárna štruktúra kyseliny uhličitej. Všimnite si, že vzorec Co (OH)2 Môže byť napísaný ako OHCOOH; to znamená typu RCOOH, kde R sa v tomto prípade stáva OH skupinou.
Z tohto dôvodu, okrem skutočnosti, že molekula pozostáva z kyslíka, atómov vodíka a uhlíka, príliš bežná v organickej chémii, ktorú kyselina uhličitá považuje za organickú zlúčeninu. Avšak v časti jeho syntézy bude vysvetlené, prečo ju iní považujú za anorganickú a neorganickú povahu.
Môže vám slúžiť: dihydroxyacetón: štruktúra, vlastnosti, získanie, použitiaMolekulárne interakcie
Molekuly h2Co3 Je možné poznamenať, že jej geometria je trigonálny byt, pričom uhlík sa nachádza v strede trojuholníka. V dvoch z jeho vrcholov má OH skupiny, ktoré sú darcami vodíka; A v zostávajúcich ďalších atómoch kyslíka skupiny C = O, akceptor vodíka mosta.
Teda h2Co3 Má silnú tendenciu interagovať s protikami alebo okysličenými rozpúšťadlami (a tiež dusíkmi).
A náhodou voda spĺňa tieto dve charakteristiky a afinita H je taká2Co3 pre ňu, ktorá jej takmer okamžite dáva h+ A hydrolýzová rovnováha, ktorá zahŕňa druhy HCO, sa začína ustanoviť3- a h3Ani+.
Preto samotná prítomnosť vody rozkladá kyselinu uhličitú a jej izolácia je príliš komplikovaná ako čistá zlúčenina.
Čistá kyselina uhličitá
Vráťte sa do molekuly H2Co3, Nielenže je plochý, schopný založiť vodíkové mosty, ale môže tiež prezentovať cis-trans Isomeía; Toto je, na obrázku, ktorý máme izoméru cis, s dvoma h smerujúcimi rovnakým smerom, zatiaľ čo v trans izoméri by ukázali opačným smerom.
Izomér CIS je najstabilnejší z oboch, a preto je to jediný, ktorý je zvyčajne zastúpený.
Čistá pevná látka H2Co3 Skladá sa z kryštalickej štruktúry zloženej z vrstiev alebo molekúl listy interakcie s bočnými vodíkovými mostmi. Očakáva sa, že je molekula h2Co3 Plochý a trojuholníkový. Keď sú sublimálne, objavia sa cyklické súmrak (h2Co3)2, ktoré sú spojené dvoma vodíkovými mostmi C = o - OH.
Symetria HR2Co3 Momenty to nebolo možné definovať. Považovalo sa za kryštalizované ako dva polymorfy: a-h2Co3 a p-h2Co3. A-H však2Co3, syntetizovaný na základe zmesi Cho3Cooh-co2, Preukázalo sa, že to bol vlastne cho3OROH: Monometrická kyselina uhličitá Ster.
Vlastnosti
Bolo spomenuté, že h2Co3 Je to diprotická kyselina, takže môžete darovať dva H ióny+ do média, ktoré ich prijíma. Ak je toto médium voda, rovnice jej disociácie alebo hydrolýzy sú:
H2Co3(Ac) + h2Alebo (l) HCO3-(Ac) + h3Ani+(Ac) (ka1 = 2,5 × 10−4)
HCO3-(Ac) + h2Alebo (l) co32-(Ac) + h3Ani+(Ac) (ka2 = 4,69 × 10−11)
HCO3- Je to anión hydrogenuhličitan alebo vodíkarbonát a CO32- Uhličitan anión. Uvádzajú tiež ich príslušné rovnovážné konštanty, ka, ka1 a ka2. Byť ka2 päť miliónov krát menších ako ka1, Tvorba a koncentrácia CO32- Sú opovrhnutiahodné.
Takže aj keď je to diprotická kyselina, druhá h+ Sotva to môžete uvoľniť značné. Prítomnosť CO2 rozpustené vo veľkých množstvách dostatočne na to, aby okyslili médium; V tomto prípade voda, ktorá znižuje svoje hodnoty pH (pod 7).
Môže vám slúžiť: fúziaHovorí sa o kyseline uhličit3- a h3Ani+; Nemôže byť izolovaný konvenčnými metódami, pretože najmenšie pokusy by vytlačili rovnováhu rozpustnosti CO2 k tvorbe bublín, ktoré by unikli z vody.
Syntéza
Rozpustenie
Kyselina uhličitá je jednou z najjednoduchších zlúčenín na syntézu. Ako? Najjednoduchšou metódou je bublina s pomocou slamy alebo sorbet, vzduch, ktorý vydýchneme vo vnútri objemu vody. Pretože vydýchneme v podstate co2, Táto bublina vo vode, rozpúšťajúca malú časť toho istého.
Keď to urobíme, nastane nasledujúca reakcia:
Co2g) + h2Alebo (l) h2Co3(Ac)
Ale na druhej strane sa musí zvážiť rozpustnosť CO2 vo vode:
Co2g) CO2(Ac)
Obidve co2 ako h2Alebo sú anorganické molekuly, tak h2Co3 Je to anorganické od tohto bodu.
Rovnováha kvapaliny
V dôsledku toho máme systém v rovnováhe, ktorý do značnej miery závisí od čiastočných tlakov CO2, ako aj teplota kvapaliny.
Napríklad, ak tlak CO2 Zvyšuje sa (v prípade, že vyhodíme vzduch viac silou cez sorbet), vytvorí sa viac H2Co3 a pH sa stane kyslejším; Od prvej rovnováhy sa pohybuje doprava.
Na druhej strane, ak zahrievame rozpustenie H2Co3, Rozpustnosť CO sa zníži2 Vo vode, pretože je to plyn a rovnováha sa potom presunie doľava (bude menej h2Co3). Podobné bude, ak sa pokúsime použiť vákuum: CO2 Unikne, ako aj molekuly vody, ktoré by opäť posunuli rovnováhu doľava.
Čisto pevná látka
Vyššie uvedené umožňuje dospieť k záveru: z roztoku H2Co3 Neexistuje spôsob, ako syntetizovať túto kyselinu ako čistú pevnú látku konvenčnou metódou. Urobilo sa to však od 90. rokov minulého storočia, počnúc pevnými zmesami CO2 a h2Ani.
Do tejto pevnej zmesi CO2-H2Alebo pri 50% je bombardovaný protónmi (typ kozmického žiarenia), takže ani jedna z týchto dvoch zložiek neunikne a dochádza k tvorbe H2Co3. Na tento účel sa použila aj zmes Cho3Oh-co2 (Pamätajte na α-H2Co3).
Ďalšou metódou je urobiť to isté, ale priamo používať suchý ľad, nič viac.
Z týchto troch metód by vedci NASA mohli dospieť k záveru: čistá, pevná alebo plynná kyselina uhličitá môže existovať v zmrzline Jupitera, v marťanských ľadovcoch a v kométach, kde sú takéto pevné zmesi neustále ožiarené pre kozmické lúče pre kozmické lúče.
Môže vám slúžiť: Volumetrická pipetka: Charakteristiky, použitia, kalibrácia a chybyŽiadosti
Samotná kyselina uhličitá je zlúčenina bez akejkoľvek užitočnosti. Zo svojich riešení však môžete pripraviť tlmené roztoky na základe kolegov HCO3-/Co32- alebo h2Co3/HCO3-.
Vďaka týmto riešeniam a pôsobeniu enzýmu karbony anhydrázy prítomného v červených krvinkách, CO2 Vyrábané v dýchaní sa môže transportovať v krvi do pľúc, kde sa konečne uvoľní na výdych mimo nášho tela.
Bubjueo CO2 Využíva to, že pije sa príjemné a charakteristické pocity, ktoré nechávajú v krku pri ich pití, keď ich pijú.
Tiež prítomnosť H2Co3 Má geologický význam pri tvorbe vápencových stalaktitov, pretože ich pomaly rozpúšťa, až kým nepochádzajú svoje špicaté povrchové úpravy.
A na druhej strane, ich roztoky sa môžu použiť na prípravu niektorých kovových bikarbonátov; Aj keď je ziskovejšia a ľahko použiteľná hydrogenuhličitanovú soľ (NAHCO3, Napríklad).
Riziká
Kyselina uhličitá má v normálnych podmienkach taký veľmi malý život (odhadujú, že asi 300 nanosekúnd), čo je prakticky neškodné pre životné prostredie a živé bytosti. Ako je však uvedené vyššie, to neznamená, že nemôže generovať znepokojujúcu zmenu v pH vode z oceánu, ktorá ovplyvňuje morskú faunu.
Na druhej strane, skutočné „riziko“ je v príjme splynutia vody, pretože množstvo CO2 Rozpustené v nich je oveľa väčšie ako v normálnej vode. A opäť, neexistujú žiadne štúdie, ktoré by ukázali, že pitie splynutej vody predstavuje smrteľné riziko; Ak ho dokonca odporučíte, aby ste sa mohli rýchlo a bojovať proti tráveniu.
Jediným negatívnym účinkom pozorovaným na tých, ktorí pijú túto vodu, je pocit plnosti, pretože ich žalúdky sú naplnené plynmi. Z toho (nehovoriac o nealkoholických nápojoch, pretože sú zložené z oveľa viac ako iba kyseliny uhličitej), dá sa povedať, že táto zlúčenina nie je vôbec toxická.
Odkazy
- Deň, r., & Underwood, a. (1989). Kvantitatívna analytická chémia (piate vydanie.). Pearson Prentice Hall.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2019). KYSELINA UHLIČITÁ. Zdroj: In.Wikipedia.orgán
- Danielle Reid. (2019). Kyselina uhličitá: Video formovania, štruktúry a chemickej rovnice. Štúdium. Získané z: štúdie.com
- Götz Bucher a Wolfram Sander. (2014). Čistenie štruktúry kyseliny uhličitej. Zvuk. 346, vydanie 6209, s. 544-545. Doi: 10.1126/veda.1260117
- Lynn Yarris. (22. októbra 2014). Nové poznatky o kyseline uhličitej vo vode. Laboratórium Berkeley. Získané z: NewsCenter.lbl.Vláda
- Claudia Hammond. (14. september 2015). Je pre vás skutočne šumivá voda? Zdroj: BBC.com
- Jürgen Bernard. (2014). Kyselina z kysliny uhličitej a plynnej kyseliny. Inštitút fyzikálnej chémie. University of Innsbruck.

