Cyklobutánska štruktúra, vlastnosti, použitie a syntéza
- 2213
- 325
- Adrián Fajnor
On Cyklobután Je to uhľovodík, ktorý pozostáva zo štvorkarbonového cyklo, ktorého molekulárny vzorec je C4H8. Môžete sa tiež nazývať tetrametylén, vzhľadom na to, že existujú štyri jednotky OSN2 ktoré tvoria prsteň s štvorcovou geometriou, hoci názov cyklobutánu je akceptovaný a známy.
Pri izbovej teplote je to bezfarebný, horiaci plyn, ktorý horí s jasným plameňom. Jeho najprimitívnejšie použitie je ako zdroj tepla jeho spaľovaním; Jeho štrukturálna základňa (štvorec) však pokrýva hlboké biologické a chemické aspekty a určitým spôsobom spolupracuje s vlastnosťami uvedených zlúčenín.
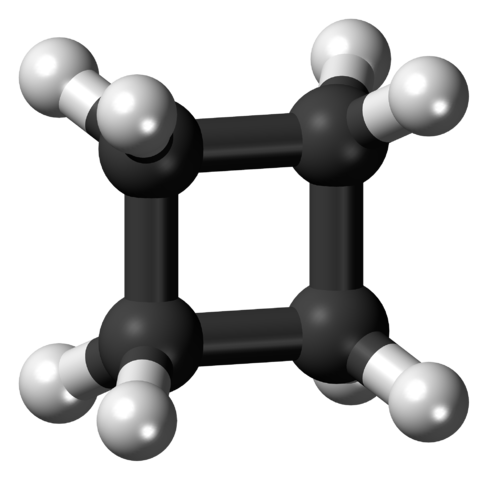 Cyklobutánska molekula v napätej konformácii. Zdroj: Jynto [CC0].
Cyklobutánska molekula v napätej konformácii. Zdroj: Jynto [CC0]. Na hornom obrázku je znázornená cyklobutánová molekula s štvorcovou štruktúrou. V nasledujúcej časti bude vysvetlené, prečo je táto konformácia nestabilná, pretože jej odkazy sú napäté.
Po cyklopropo je to najstabilnejší cykloalkan, pretože čím menšia je veľkosť kruhu, tým viac bude reaktívnejšia. Podľa toho je cyklobután nestabilnejší ako cykly Pentan a Hexano. Je však zvedavé svedčiť vo svojich derivátoch jadro alebo štvorcové srdce, ktoré, ako bude vidieť, je dynamické.
[TOC]
Cyklobután
Na prvom obrázku bola štruktúra cyklobutánu riešená ako jednoduchý uhlík a hydrogenovaný štvorec. Avšak na tomto dokonalom štvorci orbitáli trpia ťažkým podvrtnutím svojich pôvodných uhlov: sú oddelené uhlom 90 ° v porovnaní s 109,5 ° pre atóm uhlíka s hybridizáciou SPA SP SP3 (uhlové napätie).
Škvrny uhlíka3 Sú to tetraedral a pre nejakú tetraedru by bolo ťažké ohnúť obe svoje orbitály, aby vytvorili uhol 90 °; Ale bolo by to ešte viac pre uhlíky s hybridizáciami SP2 (120 °) a SP (180 °) Odvádzajte svoje pôvodné uhly. Z tohto dôvodu má cyklobután atómy uhlíka SP3 v podstate.
Môže vám slúžiť: sekundárny alkohol: Čo je, štruktúra, vlastnosti, použitiaAtómy vodíka sú tiež veľmi blízko seba, zatienené vo vesmíre. To má za následok zvýšenie stérickej prekážky, ktorá oslabuje údajné námestie pre jeho vysoké torzné napätie.
Preto uhlové a torzné napätie (zapuzdrené v termíne „prstencové napätie“) robí túto konformáciu nestabilnou za normálnych podmienok.
Cyklobután.
Motýle alebo pokrčené konformácie
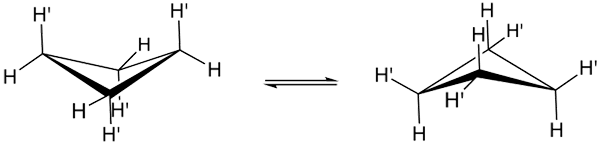 Cyklobutánové konformácie. Zdroj: Smokefoot.
Cyklobutánové konformácie. Zdroj: Smokefoot. Skutočné konformácie cyklobutanu sú uvedené vyššie. V nich sa znižuje uhlové a torzné napätie; Pretože, ako je vidieť, nie všetky atómy vodíka sú zatienené. Existujú však náklady na energiu: uhol jeho prepojení sa zhoršuje, to znamená nízky od 90 do 88 °.
Všimnite si, že sa dá porovnávať s motýľom, ktorého trojuholníkové krídla tvoria tri atómy uhlíka; a štvrtý umiestnený v uhle 25 ° vzhľadom na každé krídlo. Šípky s dvojitým zmyslom poukazujú na to, že medzi oboma konformérmi existuje rovnováha. Je to, akoby motýľ dole a vyliezol na krídla.
V tých, ktoré boli odvodené z cyklobutánu, by sa na druhej strane očakávalo, že tento štrbín bude oveľa pomalší a priestorovo zabránený.
Intermolekulárne interakcie
Predpokladajme, že na pár okamihov štvorcov zabudnete a nahradíte ich na svojom mieste sýtenými motýľmi. Nachádzate sa v ich flutterovi môže byť držané spolu v tekutine iba pomocou londýnskych disperzných síl, ktoré sú úmerné oblasti ich krídel a jej molekulárnej hmotnosti.
Môže vám slúžiť: Carbonyl Group: Charakteristiky, vlastnosti, nomenklatúra, reaktivitaVlastnosti
Fyzický vzhľad
Bezfarebný plyn.
Molekulárna hmotnosť
56,107 g/mol.
Bod varu
12,6 ° C. Preto v chladných podmienkach by sa v zásade mohlo manipulovať ako s akýmkoľvek tekutinou; S jediným detailom, že by to bolo vysoko volatilné a ich výpary by stále predstavovali riziko, že sa bude brať do úvahy.
Bod topenia
-91 ° C.
zapaľovač
50 ° C Zatvorená šálka.
Rozpustnosť
Nerozpustný vo vode, čo nie je prekvapené vzhľadom na jeho apolárnu povahu; Ale je mierne rozpustný v alkoholu, éter a acetóne, ktoré sú menej polárnym rozpúšťadlom. Očakáva sa, že bude rozpustný (hoci nie je uvedený) logicky v apolárnych rozpúšťadlách, ako je tetrachlorid uhlíka, benzén, xylén atď.
Hustota
0,7125 až 5 ° C (vo vzťahu k 1 z vody).
Hustota
1.93 (vo vzťahu k 1 vzduchu). To znamená, že je hustý ako vzduch, a preto, pokiaľ neexistujú prúdy, jeho trend nebude stúpať.
Tlak vodnej pary
1.180 mmHg pri 25 ° C.
Index lomu
1 3625 až 290 ° C.
Entalpia spaľovania
-655,9 kj/mol.
Útvary
6,6 kcal/mol A 25 ° C.
Syntéza
Cyklobután je syntetizovaný hydrogenáciou cyklobutadiénu, ktorého štruktúra je takmer rovnaká, s jediným rozdielom, že má dvojitú väzbu; A preto je ešte reaktívnejší. Toto je možno najjednoduchšia syntetická cesta, ktorá ju získala, alebo aspoň iba k nemu, a nie k derivácii.
V surovej ruchu je nepravdepodobné, že by sa získalo, pretože by to nakoniec reagovalo takým spôsobom, že prelomil prsteň a vytvoril sa čiarová reťaz, to znamená n-bután.
Ďalšou metódou na získanie cyklobutánu je ovplyvnenie ultrafialového žiarenia na molekulách etylénu, ch2= CH2, ktoré sa merajú. Táto reakcia je fotochemicky uprednostňovaná, ale nie termodynamicky:
Môže vám slúžiť: benchilo benzoate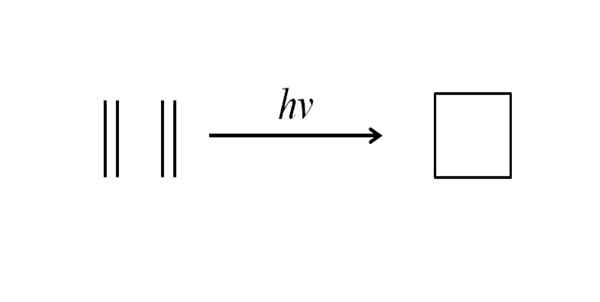 Syntéza cyklobutánu pomocou ultrafialového žiarenia. Zdroj: Gabriel Bolívar.
Syntéza cyklobutánu pomocou ultrafialového žiarenia. Zdroj: Gabriel Bolívar. Horný obrázok sumarizuje to, čo bolo uvedené v odseku vyššie. Ak namiesto etylénu to bolo napríklad akékoľvek dve alkény, získa sa nahradený cyklobután; Alebo čo je to isté, cyklobutánový derivát. V skutočnosti sa touto metódou syntetizovalo mnoho derivátov so zaujímavými štruktúrami.
Ostatné deriváty však naznačujú sériu komplikovaných syntetických krokov. Preto cyklobuta (ako sa nazývajú ich deriváty), sú predmetom štúdia organickej syntézy.
Žiadosti
Samotný cyklobután nemá viac využitie, ako slúžiť ako zdroj tepla; Jeho deriváty však vstupujú do zložitých krajín v organickej syntéze s aplikáciami vo farmakológii, biotechnológii a medicíne. Bez prehĺbenia príliš zložitých štruktúr, penitremy a grandizol sú príkladmi cyklobutánov.
Cyklobutáni majú vo všeobecnosti vlastnosti, ktoré sú prospešné pre metabolizmy baktérií, rastlín, morských bezstavovcov a húb. Sú biologicky aktívne, a preto je ich použitia veľmi rozmanité a ťažko sa dá špecifikovať, pretože každý z nich má svoj osobitný vplyv na určité organizmy.
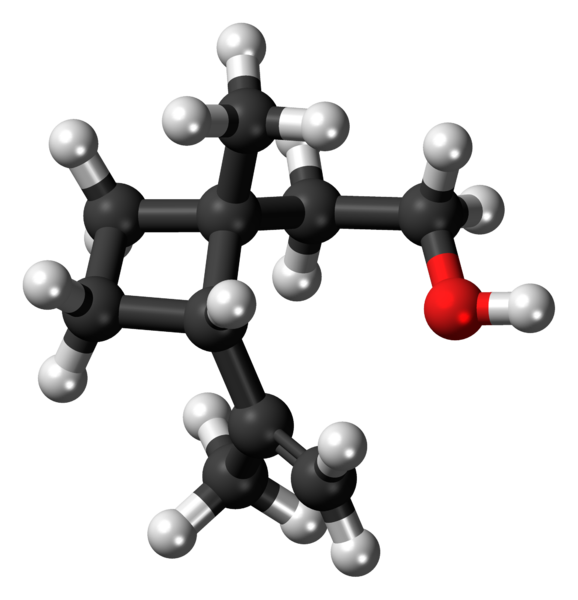
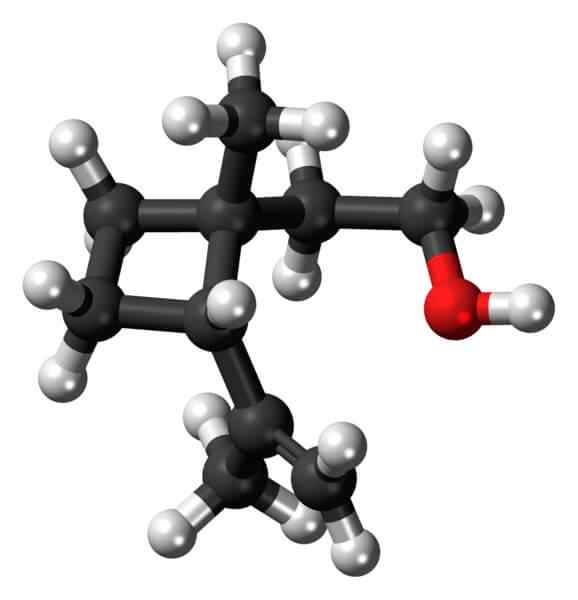 Grandisol: Príklad cyklobutánového derivátu. Zdroj: Jynto [CC0].
Grandisol: Príklad cyklobutánového derivátu. Zdroj: Jynto [CC0]. Grandisol je napríklad gorgjo feromón (typ chrobáka). Nad a nakoniec, jeho štruktúra je znázornená, považovaná za monoterpén s štvorcovou základňou cyklobutánu.
Odkazy
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Graham Solomons, T.W.; Craig B. Fryhle. (2011). Organická chémia. (jedenásťth vydanie). Mravný.
- Wikipedia. (2019). Cyklobután. Zdroj: In.Wikipedia.orgán
- Publikácia. (2019). Cyklobután. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Peiris Nicole. (29. novembra 2015). Fyzikálne vlastnosti cykloalkánov. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Wiber B. Kenneth. (2005). Cyklobután-fyzické vlastnosti a teoretické štúdie. Katedra chémie, Univerzita Yale.
- Klement foo. (s.F.). Cyklobutány v organickej syntéze. Zdroj: Scripps.Edu
- Myers. (s.F.). Syntéza cyklobutánov. Chem 115. Získané z: HWPI.Harvard.Edu
- « Štruktúra, štruktúra, vlastnosti a použitie strieborného bromuro (AGBR)
- Charakteristiky, typy a účinky syntetických liekov »

