Chemická štruktúra cykloalquenos, vlastnosti, nomenklatúra
- 2356
- 710
- Valentín Dula
Ten Cyklistika Patrí do skupiny binárnych organických zlúčenín; to znamená, že sú tvorené iba z uhlíka a vodíka. Ukončenie „nahnevaného“ naznačuje, že v ich štruktúre predstavujú dvojitú väzbu, ktorá sa nazýva nenasýtenie alebo nedostatok vodíka (naznačuje, že vo vzorci chýbajú vodiče).
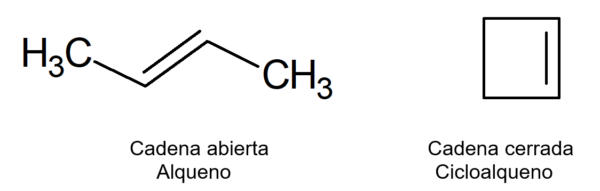
Sú súčasťou nenasýtených organických zlúčenín lineárneho reťazca nazývané alkény alebo olefíny, pretože majú mastný (olejový) vzhľad, ale rozdiel je v tom, že cykly majú uzavreté reťazce, tvoria cykly alebo krúžky alebo krúžky.
 Cycropropeno, typ cykloalquénu
Cycropropeno, typ cykloalquénu Rovnako ako v alkénoch, dvojitá väzba zodpovedá väzbe σ (vysoko energetická sigma) a π (menšia energetická pi) väzba (menšia energia). Je to posledný odkaz, ktorý umožňuje reaktivitu, aby sa jej ľahké prerušilo a tvorili voľné radikály.

Majú všeobecný vzorec, ktorý sa objaví CnH2N-2 . V tomto vzorci n označuje množstvo atómov uhlíka, ktoré má štruktúra. Najmenším cyklom je cyklopropén, znamená to, že má iba 3 atómy uhlíka a jednu dvojitú väzbu.
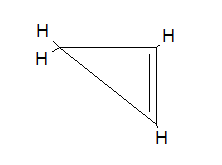
Ak chcete získať štruktúru s množstvom atómov uhlíka = 3 Aplikácia vzorec CnHN-2 Jednoducho vymeňte n 3, získanie nasledujúceho molekulárneho vzorca:
C3H2 (3) -2 = C3H6-2 = C3H4.
Potom je tu cyklus s 3 atómami uhlíka a 4 hydrogénmi, ktorý sa rovná tomu, ako sa objaví na obrázku.
Tieto chemické zlúčeniny sú veľmi užitočné na priemyselnej úrovni kvôli ich ľahkosti pri vytváraní nových látok, ako sú polyméry (v dôsledku prítomnosti dvojitej väzby), alebo na získanie cykloalkánov s rovnakým počtom atómov uhlíka, ktoré sú prekurzormi pre tvorbu tvorby Ostatné zlúčeniny.
[TOC]
Chemická štruktúra cyklov
Cykloalky sa môžu vyskytnúť vo svojej štruktúre jedna alebo niekoľko dvojitých väzieb, ktoré musia byť oddelené jednoduchým odkazom; Toto je známe ako konjugovaná štruktúra. V opačnom prípade sa medzi nimi vytvárajú odpudivé sily, ktoré spôsobujú prerušenie molekuly.
Môže vám slúžiť: transterifikácia: mechanizmus, v mastných kyselinách, v mikro riasAk má v chemickej štruktúre cykloalque dve dvojité väzby, hovorí sa, že ide o „dién“. Ak máte tri dvojité putá, je to „triná“. A ak existujú štyri dvojité odkazy, hovorí sa o „tetrane“ atď.
Najstabilnejšie štruktúry nemajú vo svojom cykle veľa dvojitých väzieb, pretože molekulárna štruktúra je zdeformovaná v dôsledku veľkého množstva energie spôsobenej pohyblivými elektrónmi, ktoré sa nachádzajú v ňom.
Jedným z najdôležitejších trénov je cyklohexatrién, zlúčenina, ktorá má šesť atómov uhlíka a tri dvojité väzby. Táto zlúčenina patrí do skupiny prvkov nazývaných piesok alebo aromatický. To je okrem iného na naftalén, Fenantreno a Anthraceno.
Menovanie
Na vymenovanie cyklov sa musia zohľadniť normy podľa Medzinárodnej únie čistej a aplikovanej chémie (IUPAC):
Cykloalquén s jednou dvojitou väzbou a bez alquilitických alebo radikálnych substituentov
- Počet uhlíkov, ktoré sa cyklus počíta.
- Slovo „cyklus“ je napísané, po ktorom nasleduje koreň, ktorý zodpovedá počtu atómov uhlíka (MET, ET, prop, ale, okrem iného), a je uvedený „hnev“, pretože zodpovedá alkenene.
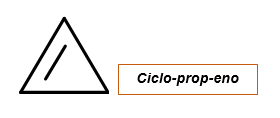
Cykloalky s dvoma alebo viacerými dvojitými väzbami a bez alquiliových alebo radikálnych substituentov
Uhlíkový reťazec je uvedený takým spôsobom, že dvojité väzby sú umiestnené medzi dvoma po sebe idúcimi číslami s najmenšou možnou hodnotou.
Čísla sú napísané oddelené čiarkami. Po dokončení číslovania je skript napísaný na oddelenie čísel od písmen.
Slovo „cyklus je potom napísané„, nasledovaný koreňom, ktorý zodpovedá počtu atómov uhlíkov, ktoré má štruktúra. Písmeno „A“ je napísané a potom je napísaný počet dvojitých dlhopisov pomocou predpony Di (dva), tri (tri), tetra (štyri), Penta (päť) atď. Končí príponou „nahnevaná“.
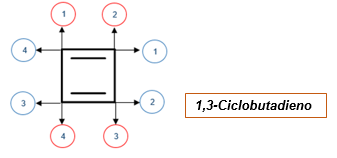
Môže vám slúžiť: piperidín: štruktúra, syntéza, deriváty, reakcieV nasledujúcom príklade sú zobrazené dva výmeny: jeden uzamknutý v červenom kruhu a druhý zamknutý v modrom kruhu.
Číslovanie červeného kruhu ukazuje správny formulár podľa štandardov IUPAC, zatiaľ čo ten zamknutý v modrom kruhu nie je správny, pretože dvojité puto nie je chápané medzi po sebe idúcimi číslami nižšej hodnoty.
Cyklovanie
S alquilalickým substituentom
Cyklus je uvedený, ako už bolo uvedené. Radikálna propil je napísaná číslovaním, ktoré zodpovedá a oddeľuje skriptom názvu hlavného reťazca:
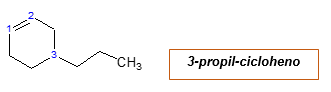 S dvoma alquilitickými substituentmi
S dvoma alquilitickými substituentmi
Číslovanie začína uhlíkom, ktorý má jeden z radikálov. To dáva najmenšiu možnú hodnotu, radikálnu aj dvojitú väzbu. Radikály sú pomenované v abecednom poradí.
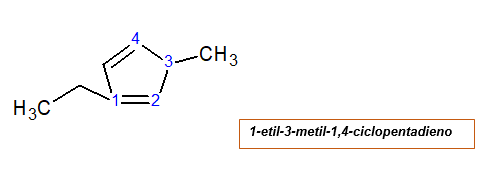
Vlastnosti cykloalku
Fyzikálne vlastnosti
Fyzikálne vlastnosti cykloalu, ktoré závisia od molekulovej hmotnosti, množstva dvojitých väzieb, ktoré vlastní, a radikálov, ktoré sú s nimi spojené.
Fyzický stav prvých dvoch cyklov (c3 a c4) Sú to plyny, do c10 Sú tekuté a odvtedy sú pevné.
Bod varu cykloalquenos je väčší v porovnaní s bodom cykloalcanov rovnakého počtu atómov uhlíka. Je to kvôli elektronickej hustote spôsobenej väzbami π (PI) dvojitého väzby, zatiaľ čo bod topenia klesá.
Hustota sa zvyšuje, keď sa zvyšuje molárna hmotnosť cyklickej zlúčeniny a môže sa zvýšiť viac so zvyšovaním dvojitých väzieb.
Pre cyklovanie je hustota 0,744 g/ml, zatiaľ čo pre cyklopentadién je hustota 0,789 g/ml.
Môže vám slúžiť: heterogénne zmesiV obidvoch zlúčeninách je rovnaký počet atómov uhlíka; Cyclopentadieno má však nižšiu molárnu hmotnosť v dôsledku neprítomnosti hydrogénov, ale má dve dvojité väzby. Vďaka tomu je jeho hustota o niečo väčšia.
Cykloalky nie sú príliš rozpustné vo vode, najmä preto, že ich polarita je v porovnaní s vodou veľmi nízka.
Sú rozpustné v organických zlúčeninách, a tak spĺňajú princíp, ktorý naznačuje, že „podobné sa rozpustí“. Vo všeobecnosti to znamená, že látky, ktoré majú podobnú intermolekulárnu štruktúru a sily, sú vzájomne miešateľnejšie ako látky, ktoré nie sú.
Chemické vlastnosti
Rovnako ako lineárne reťazové alkény, aj cykloalky majú pridanú reakcie na dvojitú väzbu na väčšiu energiu a menšiu dĺžku ako jednoduchý alebo sigma (σ) väzba (σ).
Hlavné reakcie cykloalu, ktoré sú prídavné, ale tiež vykazujú reakcie oxidácie, redukcie a halogenácie.
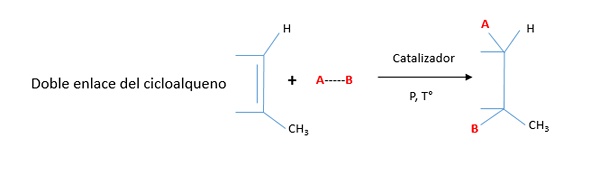
Nasledujúca tabuľka ilustruje najdôležitejšie reakcie cyklorálov:
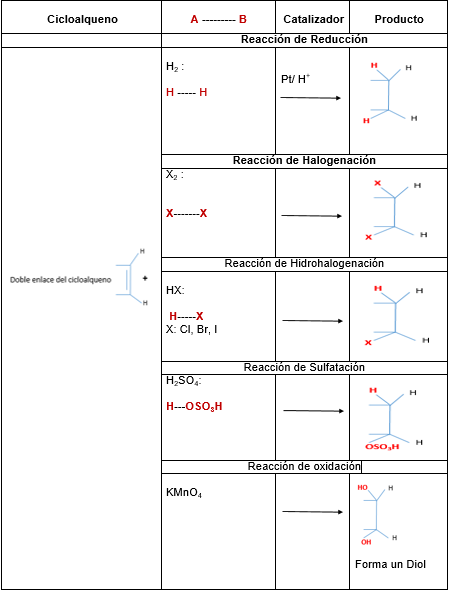
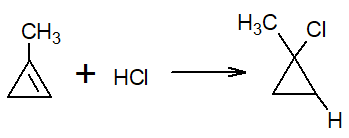
Ak je jeden z uhlíkov, ktorý má dvojitú väzbu. Toto sa nazýva Markovnicova pravidlo.
Cyklistické príklady
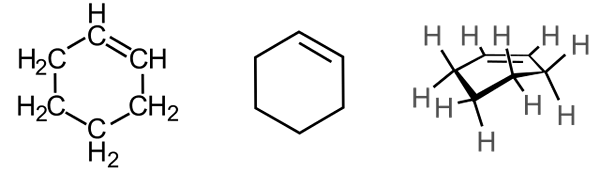 Cyklohexen
Cyklohexen - Cyklohexen: C6H10.
- Cyklobuten: C4H6.
- Cyklistika: C5H8.
- 1,5-Cyclooctadieno: C8H12.
- 1.3-Ciclobutadieno: C4H4.
- 1.3-cyklopentadieno: C5H6.
- 1,3,5,7-Cyclooctateraeno: C8H8.
- Cypropropeno.
- Cyklohepteno.
Odkazy
- Tierney, J, (1988, 12), Markownikoffova vláda: Čo povedal a kedy to povedal?.J.Chem.Pedagóg. 65, P.1053-1054.
- Hart, h; Craine, L; Hart, D. Organická chémia: Krátky kurz (deviate vydanie), Mexiko, McGraw-Hill.
- Garcia, a., Aubad, a., Zapata, r.,(1985), smerom k chémii 2, Bogotá: Temis
- Borovica, s.,Hammond, G.,Hendrickson, J., Cram, D.,(1980), Organic Chemistry (4. vydanie), Mexiko: McGraw-Hill.
- Morrison, r.,Boyd, r.,(1998), Organic Chemistry, (5. vydanie), Španielsko, Addison Wesley Iberoamericana
- « 20 domácich liekov na nižší cukor (prírodné)
- Sociálno -kritické paradigmy Charakteristiky, metódy, zástupcovia »