Štruktúra, vlastnosti, použitia, riziká, riziká oxidu bárnatého (BAO)

- 4636
- 1054
- Ing. Ervín Petruška
On oxid bárňa Je to anorganická tuhá látka tvorená atómom bárna (BA) a atómom kyslíka (O). Jeho chemický vzorec je bao. Je to biela kryštalická tuhá látka a je hygroskopická, to znamená, že absorbuje vlhkosť vzduchu, ale s tým reaguje.
Rýchla reakcia oxidu bária s vodou sa používa v laboratóriách chemickej analýzy, tj eliminovanie vody z organických rozpúšťadiel, ktoré sú kvapalné zlúčeniny, ktoré slúžia na rozpustenie iných látok.
 Pevný oxid bárna. LEM [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons.
Pevný oxid bárna. LEM [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons. Bao sa správa ako silná báza, preto reaguje s mnohými typmi kyselín. Napríklad ľahko reagujte s oxidom uhličitým2 vzduchu za vzniku uhličitanu bárňa bacchus3.
Podáva sa pri výrobe polymérov pre elektrické káble a ako zložku živíc na utesnenie otvorov zubov, ktoré boli vyliečené.
Oxid bárnatého (BAO) sa používa aj v keramickom priemysle, aby ho zakryl zasklením a jeho výrobou. Používa sa tiež v cementových zmesiach na zvýšenie kompresného odporu konečného produktu.
[TOC]
Štruktúra
Oxid bao baar je tvorený katiónom BA2+ a kyslíkový anión alebo2-.
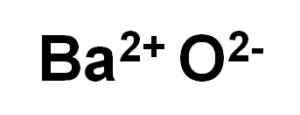 Ióny oxidu bao bária. Autor: Marilú Stea.
Ióny oxidu bao bária. Autor: Marilú Stea. Vo svojich kryštáloch BAO tvorí kubické iónové siete (vo forme kocky) typu chloridu sodného.
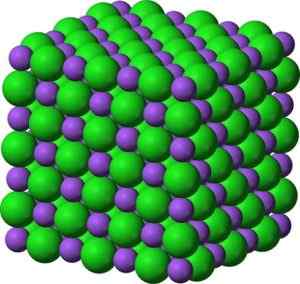 Kryštalická štruktúra v tvare oxidu bao bária podobná chloridu sodného. Zelená: Bária. Modrá: kyslík. Benjah-Bmm27 (Talk · Petrít) [verejná doména]. Zdroj: Wikimedia Commons.
Kryštalická štruktúra v tvare oxidu bao bária podobná chloridu sodného. Zelená: Bária. Modrá: kyslík. Benjah-Bmm27 (Talk · Petrít) [verejná doména]. Zdroj: Wikimedia Commons. Elektronická konfigurácia iónu bária je: [xe] 6s0 No, dva elektróny vrstvy 6S stratili. Táto konfigurácia je veľmi stabilná.
Menovanie
-Oxid bárňa
-Oxid báriu
Môže vám slúžiť: Test: Charakteristiky, typy, príklady použitiaFyzikálne vlastnosti
Fyzický stav
Žltkastá biela kryštalická pevná látka.
Molekulová hmotnosť
153,33 g/mol
Bod topenia
1923 ° C
Bod varu
Približne 2000 ° C.
Hustota
5,72 g/cm3
Rozpustnosť
Little Water Rozpustný: 3,8 g/100 ml pri 20 ° C.
Chemické vlastnosti
Oxid bario bao reaguje rýchlo2, čo je najpustnejší hydroxid medzi hydroxidmi alkalineterických kovov.
Bao + h2O → BA (OH)2
Bao je silná základňa. Reaguje exotermitne (to znamená s odlúčením tepla) so všetkými typmi kyselín.
S CO2 BAO reaguje na tvorbu uhličitanu bária bacchus3.
Bao + co2 → bacchus3
BAO je hygroskopický, pretože ak je povolený k životnému prostrediu, postupne sa spája s vlhkosťou vzduchu a vytvára BA (OH)2 ktorý je kombinovaný s oxidom uhličitým2 vzduchu, ktorý dáva uhličitan bárničňu bacchus3.
Keď sa oxid bao bária zahrieva v prítomnosti vzduchu, kombinuje sa s peroxidom peroxidom v bárni, ktorý tvorí kyslík2. Reakcia je reverzibilná.
2 bao + o2 ⇔ 2 bao2
V prítomnosti vody môže reagovať s hliníkom s alebo s FIFC Zn, ktorý tvorí oxidy alebo hydroxidy týchto kovov a generuje plynný vodík H H2.
Môžete iniciovať polymerizáciu organických zlúčenín, ktoré sa dajú polymerizovať, napríklad epoxidy.
Riziká
Môže byť toxický požitím. Nemali by ste sa kontaktovať pokožka. Je to dráždivé oči, pokožka a dýchací trakt. Môže to byť škodlivé pre nervový systém. Je schopný spôsobiť nízke hladiny draslíka, čo vedie k srdcovým a svalovým poruchám.
Získanie
Oxid bao bárnat3 S uhlím. Vytvára sa bao a uvoľňuje sa plynný oxid uhoľnatý.
Bacchus3 + C → Bao + 2 CO ↑
Žiadosti
Ako vysúšanie organických rozpúšťadiel
Vďaka svojej ľahkosti reagovať s vodou sa BAO používa od polovice posledného storočia ako vysúšanie benzínu a základných organických rozpúšťadiel.
Môže vám slúžiť: kyselina cyanhydrová: molekulárna štruktúra, vlastnosti, používaBAO je okolo neho veľmi aktívny, berie veľmi rýchlo vlhkosť, s vývojom pomerne tepla a tvorí hydroxid bária BA (OH)2 ktorý je stabilný do asi 1 000 ° C. Preto sa bao môže použiť pri vysokých teplotách.
Má tiež vysokú kapacitu absorpcie vody. Pre každú molekulu Bao je možné absorbovať vodu a BA (OH)2 Výsledok môže tiež absorbovať určité množstvo vody.
Je vhodný pre laboratóriá analytickej chémie. Nie je to lepkavé.
Môže sa používať v sušení, ktoré sú veľkým skleneným nádobám s vekom, kde sa udržiava suchá vnútorná atmosféra. Bao udržuje miniatmosféru sušenia suchý.
 Odlíšenia v laboratóriu. Sušená pevná látka, ako je bao, je umiestnená na spodnej časti základne. Originálny uploader bol Rifleman 82 na anglickej Wikipédii. [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/]]. Zdroj: Wikimedia Commons.
Odlíšenia v laboratóriu. Sušená pevná látka, ako je bao, je umiestnená na spodnej časti základne. Originálny uploader bol Rifleman 82 na anglickej Wikipédii. [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/]]. Zdroj: Wikimedia Commons. Títo sušení slúžia na umiestňovanie látok alebo reagencií, a tak im bránia v absorbovaní vody z životného prostredia.
Podáva tiež na sušenie základných plynov, ako je amoniak NH3.
V sťahovaní žiaroviek
Bao je umiestnený v elektródach vypúšťacích žiaroviek ako materiál na emilovanie elektrónu.
Vypúšťacie žiarovky sú tvorené sklenenou trubicou, kremeňom alebo iným vhodným materiálom, obsahujú inertný plyn a vo väčšine prípadov kovová pary. Kovová para môže byť sodík alebo ortuť.
 Ortuťová lampa. Dmitry G [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
Ortuťová lampa. Dmitry G [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons. Vo vnútri trubice dochádza k elektrickému šoku, pretože má pozitívnu a negatívnu elektródu.
Bao je umiestnený do elektród žiarovky. Elektróny emitované zrážajú sa s kovovými atómami pary a vysiela energiu.
Môže vám slúžiť: Cupric Oxid (CUO)Pri prechádzaní elektrickým prúdom cez tento plyn alebo para je viditeľné svetlo alebo ultrafialové žiarenie (UV).
V keramickej výrobe
Bao sa používa v glazúrovaných keramických poťahovacích kompozíciách.
 Potiahnutá stavebná fasáda s zasklenou keramikou. Penny Mayes/Glazed Fasade. Zdroj: Wikimedia Commons.
Potiahnutá stavebná fasáda s zasklenou keramikou. Penny Mayes/Glazed Fasade. Zdroj: Wikimedia Commons. Pri príprave HOP sa však testoval aj ako prísadka.
BAO účinne zlepšuje mechanické vlastnosti a chemickú odolnosť tohto typu keramiky. Má silný vplyv na tepelné vlastnosti a zloženie kryštalickej fázy získaných materiálov.
Pri príprave zmesí cementu
Bao bol testovaný ako súčasť fosfoaluminátového cementu.
Tento typ cementu je užitočný v morských prostrediach, pretože nemá rovnakú tendenciu hydratovať ako iné typy cementu, takže netrpí pórmi ani expanziou.
Fosfoaluminačné cementy sa však musia posilniť pri ich mechanickom výkone, aby sa mohli vydržať morských prúdov a úderov plávajúcich kúskov ľadu prítomných v oceáne.
Pridanie bao do fosfoaluminácie cementu modifikuje minerálnu štruktúru uvedeného materiálu, zlepšuje štruktúru pórov a výrazne zvyšuje tlakovú silu cementovej pasty.
Inými slovami, BAO zlepšuje odolnosť v oblasti kompresie tohto typu cementu.
 Zmes na betón. Oxid bao bária je užitočný na zlepšenie určitých vlastností cementu. Thamizhpparithi Maari [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
Zmes na betón. Oxid bao bária je užitočný na zlepšenie určitých vlastností cementu. Thamizhpparithi Maari [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons. V niekoľkých aplikáciách
Používa sa ako zložka na zabezpečenie nepriehľadnosti v zubných živákoch na vyplnenie dier v zuboch, ktoré vykonávajú zubári.
Používa sa tiež ako nukleačné činidlo na prípravu polyvinylidénových fluoridových polymérov, ktoré sa používajú na izoláciu elektrických káblov.
Odkazy
- Partyka, J. a kol. (2016). Vplyv pridávania bao na spekanie sklenených keramických materiálov zo spoločnosti SIO2-Do2Ani3-Nat2V poriadku2O-CAO/MGO systém. J Term Anal Calim (2016) 125: 1095. Odkaz obnovený.Prubár.com.
- Zhang, P. a kol. (2019). Vplyv bao na minerálnu štruktúru a hydratačné správanie fosfoaluminátového cementu. J Term Anal Calim (2019) 136: 2319. Odkaz obnovený.Prubár.com.
- Alebo.Siež. Lekárska knižnica. (2019). Oxidový bária. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Smith, n.Do. (2003). Osvetlenie. Zásada. V referenčnej knihe Electrical Engineer (šestnáste vydanie). Zotavené z vedeckých pracovníkov.com.
- EbNejjad, s. (2003). Fluoropolymérne peny. Penenie PVDF. V spracovateľných fluórplastiach taveniny. Zotavené z vedeckých pracovníkov.com.
- Booth, h.Siež. a McIntyre, L.H. (1930). Oxid bárnat. Indiánsky. Breh. Chem. Análny. Edimatizovať. 1930, 2, 1, 12-15. Získané z krčiem.ACS.orgán.
- « Štruktúra kyanidu sodného (NACN), vlastnosti, riziká, použitie
- 15 najlepších potravín na zvýšenie zadku (prírodné) »

