Charakteristiky katalázy, štruktúra, funkcie, patológie
- 3864
- 306
- Denis Škriniar
Ten kataláza Je to oxidoreduktázový enzým (H2O2: H202 oxidorreduktáza) široko distribuovaný v prírode. Katalyzuje v rôznych tkanivách a typoch buniek, reakcia „rozkladu“ peroxidu vodíka v molekulárnom kyslíku a vode.
Prvé pozorovania tohto typu enzýmu sa datujú do začiatku 1810, ale v roku 1901, keď Loew uznal, že kataláza je prakticky prítomná vo všetkých existujúcich živých organizmoch a vo viacerých typoch rôznych buniek.
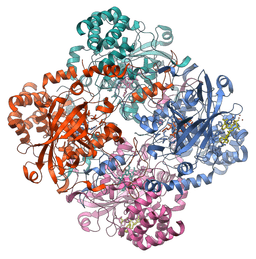
 Molekulárna štruktúra katalázového enzýmu (zdroj: Vossman [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Via Wikimedia Commons)
Molekulárna štruktúra katalázového enzýmu (zdroj: Vossman [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Via Wikimedia Commons) Tento enzým, ktorý je rozhodujúci pre udržiavanie bunkovej integrity a hlavného regulátora metabolizmu peroxidu vodíka, bol základným faktorom, ktorý potvrdil, že v prírode existujú enzýmy, ktoré pôsobia na špecifické substráty.
Cicavce a iné organizmy majú enzýmy Catalas, ktoré sa môžu správať aj ako peroxidázy, katalyzujúce oxidačné reakcie rôznych substrátov pomocou peroxidu vodíka.
Vo väčšine eukaryotov sú enzýmy Catalas prevažne v subcelulárnych organelách známe ako „peroxizómy“ a u ľudí existuje veľa patologických podmienok súvisiacich s nedostatkom tohto enzýmu.
[TOC]
Charakteristika
Aktivita enzýmov, ako je kataláza, sa môže značne meniť v závislosti od typu uvažovaného tkaniva. Napríklad u cicavcov je aktivita katalázy významná v obličkách aj v pečeni a je oveľa nižšia v spojivových tkanivách.
Takže kataláza u cicavcov je spojená hlavne so všetkými tkanivami, ktoré majú významný aeróbny metabolizmus.
Cicavce majú kataly tak v mitochondriách aj v peroxizómoch a v oboch kompartmentoch sú enzýmy spojené s organickými membránami. V erytrocytoch je naopak aktivita katalázy spojená s rozpustným enzýmom (nezabudnite, že erytrocyty majú zriedkavé vnútorné organely).
Môže vám slúžiť: Half Stuart: Nadácia, príprava a použitiaKataláza je enzým s vysokým počtom náhradných alebo konštantných katalytických (je veľmi rýchly a účinný) a všeobecná reakcia, ktorá katalyzuje, je nasledujúca:
2H2O2 → 2H2O + O2
V prítomnosti nízkych koncentrácií peroxidu vodíka sa napríklad kataláza cicavcov správa ako oxidáza, s použitím molekulárneho kyslíka (O2) na oxidáciu molekúl, ako je indol a p-penyletylamín, prekurzory tryptofánovej kyseliny a neurotransmiter, respektíve.
V súčasnosti sú známe niektoré konkurenčné inhibítory aktivity katalázy a medzi nimi vynikajú sodík a 3-amyniazolový azid. Azida je vo svojej aniónovej forme silným inhibítorom iných proteínov s hemo skupinami a používa sa na elimináciu alebo prevenciu rastu mikroorganizmu v rôznych podmienkach.
Štruktúra
U ľudí je kataláza kódovaná génom 34 kb, ktorý má 12 intrónov a 13 exónov a kóduje pre 526 aminokyselinový proteín.
Väčšina študovaných katalasov sú tetramerické enzýmy s molekulovou hmotnosťou blízko 240 kDa (60 kDa pre každú podjednotku) a každý monomér je spojený s protetickou skupinou hemínu alebo ferroprotopofirínu.
Jeho štruktúra sa skladá zo štyroch domén zložených zo sekundárnych štruktúr tvorených Alfa Hellices a β-spýšené listy a štúdie uskutočňované v enzýme pečene ľudí a hovädzieho dobytka ukázali, že tieto proteíny sú spojené so štyrmi molekulami NADPH.
Tieto molekuly NADPH sa nezdajú byť nevyhnutné pre enzymatickú aktivitu katalázy (na výrobu vody a kyslíka z peroxidu vodíka), ale zdá sa, že súvisí so znížením citlivosti tohto enzýmu v porovnaní s vysokými koncentráciami jeho toxického substrátu.
Domény každej podjednotky v kataláze ľudí sú:
Môže vám slúžiť: karotenoidy-Predĺžené neglobulárne N-terminálne rameno, ktoré funguje na stabilizáciu kvartérnej štruktúry
-Β-barel ôsmich antiparally p-tops, ktoré poskytujú niektoré zvyšky laterálneho spojenia skupine Hemo skupiny
-Doména „zabalenia“, ktorá obklopuje vonkajšiu doménu, vrátane skupiny Hemo a nakoniec
-Doména so štruktúrou vrtuľového alfa
Štyri podjednotky so týmito štyrmi doménami sú zodpovedné za tvorbu dlhého kanála, ktorého veľkosť je rozhodujúca pre mechanizmus rozpoznávania peroxidu vodíka enzýmom (ktorý pre IT používa aminokyseliny, ako je histidín, asparagín, glutamín a kyselina asparátová ).
Funkcia
Podľa niektorých autorov kataláza plní dve enzymatické funkcie:
-Rozklad peroxidu vodíka v molekulárnej vode a kyslíku (ako špecifická peroxidáza).
-Oxidácia darcov protónov, ako je metanol, etanol, mnoho formálnych fenolov a kyseliny, s použitím molu peroxidu vodíka (ako je nešpecifická peroxidáza).
-V erytrocytoch sa zdá, že veľké množstvo katalázy hrá dôležitú úlohu pri ochrane hemoglobínu pred oxidačnými činidlami, ako je peroxid vodíka, kyselina askorbová, metylhydrazín a ďalšie.
Enzým prítomný v týchto bunkách je zodpovedný za obranu iných tkanív s malou katalázovou aktivitou v porovnaní s vysokými koncentráciami peroxidu vodíka.
-Niektorý hmyz, ako napríklad bombardový chrobák, používajú katalázu ako obranný mechanizmus, pretože peroxid vodíka sa rozkladá a používa plynný kyslík produktu uvedenej reakcie na pohon výstupu vody a iných chemických zlúčenín vo forme.
-V rastlinách je kataláza (tiež prítomná v peroxizómoch) jednou z komponentov mechanizmu fotorerspirácie, počas ktorého sa fosfoglykát produkovaný enzýmom Rubisco používa na výrobu 3-fosfoglyceleratera.
Môže vám slúžiť: Loos cyklusSúvisiace patológie u ľudí
Hlavné zdroje produkcie katalázového substrátu, peroxid vodíka, sú reakcie katalyzované oxidázovými enzýmami, reaktívnymi druhmi kyslíka a niektorými nádorovými bunkami.
Táto zlúčenina sa podieľa na zápalových procesoch, na expresii adhezívnych molekúl, v apoptóze, pri regulácii agregácie krvných doštičiek a pri kontrole proliferácie buniek.
Ak existujú nedostatky tohto enzýmu, generujú sa vysoké koncentrácie jeho substrátu, ktorý vytvára lézie v bunkovej membráne, defekty v elektronickom transporte v mitochondriách, v metabolizme homocysteínu a DNA.
Medzi chorobami spojenými s mutáciami v kódujúcom géne je možné spomenúť katalázu ľudí:
-Mellitus cukrovka
-Arteriálna hypertenzia
-Alzheimerova choroba
-Vitiligo a ďalší
Odkazy
- Agar, n., Sadrzadeh, s., Findo, p., & Eaton, J. (1986). Erytrocytová kataláza. Obrana somatickej oxidantu? J. Klin. Investovať., 77, 319-321.
- Góth, L., Rass, P., & Platiť. (2004). Mutácie enzýmov katalázy a ich spojenie s návrhmi. Molekulárna diagnostika, 8(3), 141-149.
- Kirkman, h., & Gaetanit, G. F. (1984). Kataláza: Tetramerický enzým so štyrmi pevne viazanými molekulami NADPH. Proc. Natl. Šupka. Sci. Využívanie, 81, 4343-4347.
- Kirkman, h. N., & Gaetani, G. F. (2006). Cicavčie kataláza: Ctihodný enzým s novými záhadami. Trendy v biochemických vedách, 32(1), 44-50.
- Rawn, J. D. (1998). Biochémia. Burlington, Massachusetts: Vydavatelia Neil Patterson.
- Šalamún, e., Berg, L., & Martin, D. (1999). Biológia (5. vydanie.). Philadelphia, Pensylvánia: Vydavateľstvo Saunders College.
- Vinshtein, B., Melik-Adamyan, W., Barynin, V., Vagin, a., & Grebenko, a. (1981). Trojrozmerná štruktúra enzýmu katalázy. Povaha, 293(1), 411-412.
- « Charakteristiky Lacasas, štruktúra, funkcie
- Rovnomerne zrýchlené charakteristiky priamočiarého pohybu, vzorce »

