Formálne zaťaženie
- 4626
- 1029
- Tomáš Mydlo
Čo je formálne zaťaženie?
Ten Formálne zaťaženie (Cf) je taký, ktorý je priradený k atómu molekuly alebo iónu, ktorý v závislosti od toho umožňuje vysvetliť jeho štruktúry a chemické vlastnosti. Tento koncept znamená zváženie maximálneho charakteru kovalencie v spojení A-B; to znamená, že dvojica elektrónov je zdieľaná rovnako medzi A a B.
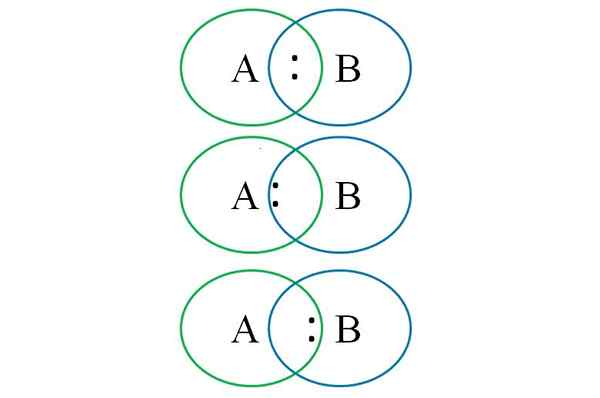
Aby sme pochopili vyššie uvedené v dolnom obrázku. Ako je zrejmé, pri odpočúvaní kruhov sa vytvára spojenie s párom „:“. V tejto heteronukleárnej molekule, ak A a B majú rovnakú elektronegativitu krútiacim momentom “.

Avšak vzhľadom na to, že dva rôzne atómy nemôžu mať rovnaké vlastnosti, pár „:“ je priťahovaný, ku ktorým je viac elektronegatívny. V tomto prípade, ak je A viac elektronegatívna ako B, pár „:“ je bližšie k bližšie k B. Opak sa vyskytuje, keď B je viac elektronegatívny ako A, teraz sa blíži „:„ B.
Potom, aby ste priradili formálne poplatky A aj B, je potrebné zvážiť prvý prípad (ten nad obrázkom). Ak by sa zlomil čisto kovalentné spojenie A-B, došlo by k homolitickému rozpadu, ktorý by generoval voľné radikály a · a · b.
Kvalitatívne výhody používania formálneho zaťaženia
Elektróny nie sú pevné, ako v predchádzajúcom príklade, ale cestujú a stratia sa atómami molekuly alebo iónu. Ak ide o diatomickú molekulu, je známe, že pár „:“ sa musí zdieľať alebo putovať medzi oboma atómami; To isté sa deje v molekule typu A-B-C, ale s väčšou zložitosťou.
Ak sa však atóm študuje a predpokladá sa, že stopercentná kovalencia vo svojich prepojeniach je ľahšie zistiť, či v zlúčenine vyhrá alebo stráca elektróny. Na určenie tohto zisku alebo straty musí byť váš bazálny alebo voľný stav porovnávaný s elektronickým prostredím.
Môže vám slúžiť: Amagat zákon: Vysvetlenie, príklady, cvičeniaTýmto spôsobom je možné priradiť kladné zaťaženie (+), ak atóm stratí elektrón alebo záporné zaťaženie (-), keď naopak vyhráva elektrón (znaky musia byť napísané vo vnútri kruhu).
Aj keď elektróny nemôžu byť presne umiestnené, tieto formálne zaťaženie (+) a (-) v štruktúrach sú vo väčšine prípadov upravené podľa očakávaných chemických vlastností.
To znamená, že formálne zaťaženie atómu úzko súvisí s molekulárnou geometriou jeho prostredia a reaktivitou v zlúčenine.
Vzorec a ako ho vypočítať
Sú formálne zaťaženia ľubovoľne pridelené? Odpoveď je nie. Z tohto dôvodu sa musí zisk alebo strata elektrónov vypočítať predpokladaním čisto kovalentných väzieb, a to sa dosahuje prostredníctvom nasledujúceho vzorca:
Cf = (číslo skupiny atómov) - (počet odkazov, ktoré tvarujú) - (počet rozbalených elektrónov)
Ak má atóm CF s hodnotou +1, priradí sa kladné zaťaženie ( +); Zatiaľ čo ak máte CF s hodnotou -1, je mu priradené záporné zaťaženie ( -).
Na správne vypočítanie CF je potrebné nasledovať kroky nižšie:
- Vyhľadajte, ktorá skupina je atómom v rámci periodickej tabuľky.
- Počítajte počet odkazov, ktoré sa formujú so svojimi susedmi: dvojité odkazy (=) majú hodnotu dva a trojité odkazy majú hodnotu tri (≡).
- Nakoniec, počítanie počtu nezdieľaných elektrónov, ktoré sa dajú ľahko pozorovať pomocou Lewisových štruktúr.
Výpočtové variácie podľa štruktúry
Vzhľadom na lineárnu molekulu A-B-C-D, formálne zaťaženie pre každý atóm sa môže meniť, ak je napríklad štruktúra napísaná ako: B-C-A-D, C-A-B-D, A-C-D-B atď. Je to preto, že existujú atómy, ktoré zdieľaním ďalších elektrónov (formou viac dlhopisov) získavajú pozitívny alebo negatívny CF.
Môže vám slúžiť: menisku (chémia)Ktorý z troch možných molekulárnych štruktúr zodpovedá zlúčenine ABCD? Odpoveď znie: tá, ktorá vo všeobecnosti má najnižšie hodnoty CF; Tiež ten, ktorý priraďuje záporné zaťaženie (-) k najviac elektronegatívnym atómom.
Ak sú C a D viac elektronegatívne ako A a B, potom zdieľaním ďalších elektrónov, následne získavajú pozitívne formálne zaťaženie (zrejmé z konzervy).
Najstabilnejšia štruktúra a najvýhodnejšia energia je teda C-A-B-D, pretože v C aj B tvoria iba jeden odkaz. Na druhej strane, štruktúra A-B-C-D a tie, ktoré majú C alebo B tvoriace dva odkazy (-C- alebo -d-), sú nestabilnejšie.
Ktorá zo všetkých štruktúr je najstabilnejšia? A-C-D-B, pretože nielen C a D tvoria dve odkazy, ale aj ich negatívne formálne zaťaženie (-) susedia navzájom, čo ďalej destabilizujú štruktúru.
Príklady výpočtov formálneho zaťaženia
Bf4- (Tetrafluoroborato ión)
Atóm bóru je obklopený štyrmi atómami fluóru. Pretože B patrí do skupiny IIIA (13), nemá zdieľané elektróny a tvorí štyri kovalentné väzby, jeho CF je (3-4-0 = -1). Namiesto toho pre F, prvok skupiny VIIA (17), jeho CF je (7-6-1 = 0).
Na určenie zaťaženia iónu alebo molekuly stačí pridať jednotlivé CF atómov, ktoré ho tvoria: (1 (-1) + 4 (0) = -1).
CF pre B však nemá skutočný význam; To je o tom, že neobsahuje najväčšiu elektronickú hustotu. V skutočnosti je táto elektronická hustota distribuovaná do štyroch atómov F, oveľa viac elektronegatívneho prvku ako b.
Môže vám slúžiť: slabá kyselinaBrať do úvahy2 (hydrid berylia)
Atom Berylium patrí do skupiny IIA (2), tvorí dva odkazy a opäť chýbajú nezdieľané elektróny. CF pre BE a H sú teda:
CfByť= 2-2-0 = 0
CfH= 1-1-0 = 0
Zaťaženie2= 1 (0) + 2 (0) = 0
CO (oxid uhoľnatý)
Jeho štruktúra Lewisu môže byť reprezentovaná ako: C≡o: (aj keď predstavuje iné rezonančné štruktúry). Opakovanie výpočtu CF, tentoraz pre C (skupiny DPH) a O (zo skupiny VIA), máte:
CfC= 4-3-2 = -1
CfAni= 6-3-2 = +1
Toto je príklad, keď formálne poplatky nezodpovedajú povahe prvkov. Alebo je viac elektronegatívna ako C, a preto by nemala nosiť pozitívny.
Ostatné štruktúry (c = o a (+Co(-)), hoci sú v súlade s koherentným prideľovaním zaťaženia, nedodržiavajú pravidlo oktetu (C má menej ako osem elektrónov Valencie).
NH4+ (iónový amónny), NH3 a NH2- (Amiduro ión)
Čím viac elektrónov zdieľa N, tým pozitívnejšie je jeho CF (na ión amónneho, pretože nemá dostupnosť energie na vytvorenie piatich dlhopisov).
Tiež použitie výpočtov pre N amoniak, amoniak a amiduro ión, potom majú:
Cf = 5-4-0 = +1 (nh4+)
Cf = 5-3-2 = 0 (nh3)
A nakoniec:
Cf = 5-2-4 = -1 (nh2-)
To znamená, v NH2- N má štyri nezdieľané elektróny a zdieľajú všetko, keď tvorí NH4+. CF pre H sa rovná 0, a preto je váš výpočet uložený.

