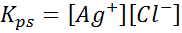Hromadná akcia

- 4516
- 1276
- JUDr. Rudolf Čapkovič
 Zrážacia reakcia zahŕňa rovnováhu rozpustnosti, ktorá sa riadi zákonom o hromadnom konaní
Zrážacia reakcia zahŕňa rovnováhu rozpustnosti, ktorá sa riadi zákonom o hromadnom konaní Aký je zákon o hromadnej akcii?
Ten Hromadná akcia uvádza, že rýchlosť reakcie závisí od koncentrácie jej reaktantov zvýšených na jeho stechiometrické koeficienty. Tento zákon umožňuje vzájomne sa vzťahovať koncentrácie v rovnováhe reaktantov a produkty reverzibilnej chemickej reakcie. Inými slovami, vytvára vzorec rovnovážnej konštanty.
Zákon o hromadnej akcii bol vyhlásený nórskymi (a krémovými) chemikmi Cato M. Guldberg (1836-1902) a Peter Waage (1833-1900) v roku 1864. Toto je jeden zo základných zákonov chémie, pretože nám umožňuje vypočítať konečné koncentrácie v rovnováhe z počiatočných sumov.
Okrem toho nám masové právo tiež umožňuje ľahko porozumieť účinkom zmien v koncentráciách ktoréhokoľvek z druhov na rovnováhu. Inými slovami, umožňuje nám pochopiť, ako fungujú princípy Le Chatlier.
Napriek tomu, že sa nazýva „zákon o hromadnom konaní“, v skutočnosti sa netýka masy reaktantov a výrobkov, ale skôr na ich koncentráciu. Dôvod, ktorý sa nazýva zákon o hromadnom konaní, a nie zákon o koncentrácii, je ten, že koncentrácia sa nazývala „aktívna hmota“.
Zákon o hromadnej akcii a rovnovážna konštanta
Podľa zákona o hromadnom konaní, keď reverzibilné reakcie dosiahnu rovnováhu, nie je to preto, že sa reakcia zastaví. Naopak, rovnováha sa dosiahne, keď sa rýchlosť priamej reakcie vykonáva rovná rýchlosti inverznej reakcie. Keď sa tak stane, všetky chemické druhy sa vyskytujú a konzumujú rovnakou rýchlosťou, takže ich koncentrácie sa stávajú konštantnými (prestanú sa meniť).
Môže vám slúžiť: toluén: štruktúra, vlastnosti, použitie, získanieGuldberg a Waage zistili, že rýchlosti oboch reakcií (priame a inverzné) závisia od molárnej koncentrácie (v mol/l) od ich činidiel zvýšených na stechiometrické koeficienty. Z týchto pozorovaní sa im podarilo nájsť vzorec pre rovnovážnu konštantu.
Podľa tohto zákona pre akúkoľvek reverzibilnú chemickú reakciu, ktorá dosahuje rovnováhu,
„… Vzťah medzi produktom molárnych koncentrácií produktov zvýšených na ich stechiometrické koeficienty a produktom molárnych koncentrácií reaktantov zvýšených na ich stechiometrické koeficienty je konštantný pri určitej teplote.„
Táto konštanta sa nazýva „rovnovážna konštanta“ a je znázornená symbolom Kc.
Rovnovážna konštanta vzorec
Pozrime sa, ako predchádzajúce vyhlásenie vyzerá vo forme matematickej rovnice. Je to reverzibilná chemická reakcia, ako je reakcia uvedená nižšie, kde A a B sú reaktanty, C a D Produkty a A, B, C a D sú príslušné stechiometrické koeficienty vyváženej reakcie:
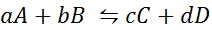
Pre generickú reakciu, ako je táto, je rovnovážna konštanta daná:
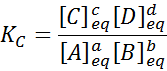
kde [a], [b], [c] a [d] sú molárne koncentrácie A, B, C a D v rovnováhe.
Tlak rovnováhy
Predchádzajúci vzorec pre rovnovážnu konštantu sa vzťahuje na akúkoľvek chemickú reakciu, v ktorej sú všetky látky v rovnakej fáze (to znamená, že všetky sú vo vodnej fáze alebo napríklad vo fáze plynu). V prípade reakcií plynnej fázy je však pohodlnejšie pracovať s tlakmi ako s koncentráciami.
Pretože molárna koncentrácia plynov je úmerná ich čiastočnému tlaku, potom je možné z hľadiska týchto tlakov prepísať vzorec rovnovážnej konštanty:
Môže vám slúžiť: 30 použití karboxylových kyselín v každodennom živote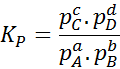
Kde pDo, pB, pC A pD Sú to čiastočné tlaky A, B, C a D a A, B, C a D zostávajú stechiometrické koeficienty. V tomto prípade kP Nazýva sa konštantná rovnováha v tlakoch a súvisí s KC Cez nasledujúci vzorec:
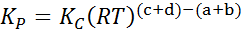
kde r je univerzálna konštanta ideálnych plynov a t je absolútna teplota v Kelvin.
Reakcie zahŕňajúce viac ako jednu fázu
Chemická reakcia niekedy zahŕňa tvorbu tuhej látky ako zrazeniny z roztoku alebo tvorbu kvapaliny z reaktantov, ktoré reagujú v plynnej fáze. V týchto prípadoch sa reakcia nedeje v rovnakej fáze, takže musíme modifikovať rovnovážnu konštantnú vzorec.
Našťastie sú úpravy veľmi jednoduché. Jediná vec, ktorú musíme vziať do úvahy pri písaní vzorca rovnovážnej konštanty, je to, že čisté látky, ktoré sa javia ako pevné látky alebo kvapaliny, by ich nemali brať do úvahy. Ak je to potrebné, namiesto toho umiestnime 1.
Záverom možno povedať, že zákon o hromadnej akcii umožňuje napísať vzorec rovnovážnej konštanty v koncentráciách aj v čiastočných tlakoch. Po poznaní jedného z nich je možné nájsť od prvého.
Nakoniec musíme byť opatrní a preskúmať fázu, v ktorej sa nachádzajú všetky chemické druhy, aby sme vedeli, či ich musíme zahrnúť do rovnovážnej konštanty.
Príklady používania zákona o hromadnej akcii
V nasledujúcich príkladoch ukazujeme, ako použiť zákon o hromadnej akcii na písanie vzorcov rovnovážnych konštánt pre rôzne typy chemických reakcií.
Reakcie reakcií v plynnom stave
Príklad 1: Rozklad n2Ani4 v plynovej fáze
N2Ani4 Je to hnedý plyn, ktorý sa rozkladá podľa nasledujúcej reakcie:
Môže vám slúžiť: kyselina Láurová: štruktúra, vlastnosti, použitia, výhody, účinky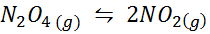
 Vzorka NO2 pri rôznych teplotách ukazujúcich vytesnenie rovnováhy na hnedý N2O4
Vzorka NO2 pri rôznych teplotách ukazujúcich vytesnenie rovnováhy na hnedý N2O4 Na túto reakciu sú rovnovážné konštanty v koncentráciách a tlakoch dané:
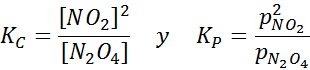
Príklad 2: Oxidácia oxidu uhoľnatého
Oxid uhoľnatý je veľmi toxický plyn, ktorý sa môže stať oxidom uhličitého pri reakcii s kyslíkom podľa nasledujúcej reakcie:
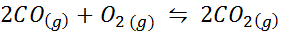
Na túto reakciu sú rovnovážné konštanty v koncentráciách a tlakoch dané:
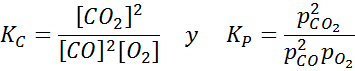
Zostatky na báze kyseliny vo vodnej fáze
Príklad 3: Vodná self -dĺžka
Iónová rovnováha vody, tiež známa ako reakcia na vodu, je reverzibilná reakcia medzi dvoma molekulami vody v kvapalnom stave. Reakcia je:
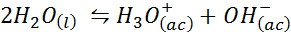
Pri písaní rovnovážnej konštanty pre túto reakciu musíme vziať do úvahy, že v tomto prípade je jediným činidlom čistá kvapalina, ktorej koncentrácia je prakticky konštantná. Z tohto dôvodu nie je zahrnutá do vzorca rovnovážnej konštanty:
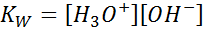
Toto je veľmi dôležitá rovnovážna konštanta, ktorá prijíma svoje vlastné meno (konštanta iónového produktu vody) a jeho vlastný symbol (KW. W sa odvoláva na vodu v angličtine, ktorá sa hovorí toaleta, WC). Je to však konštanta rovnováhy v koncentráciách ako každý iný.
Vyváženie rozpustnosti
Príklad 4: Rovnováha rozpustnosti chloridu strieborného chloridu
Keď pripravíme nasýtený roztok, vytvorí sa rovnováha rozpustnosti. V tomto prípade je rovnováha rovnováha rozpustenia chloridu striebra, ktorého reakcia je daná:
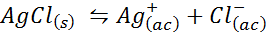
Rovnovážna konštanta tejto reakcie (a všetkých reakcií roztoku) nezahŕňa chlorid strieborného (AGCL), pretože je tuhá látka. Okrem toho, rovnako ako v prípade vody, tieto konštanty dostávajú aj špeciálne meno, ktoré je „konštantné z produktu rozpustnosti“, znázornené ako K$: