Štruktúra uhličitanu lítium (LI2CO3), vlastnosti, použitie

- 2434
- 571
- JUDr. Rudolf Čapkovič
On uhličitan lítium Je to anorganická tuhá látka tvorená dvoma lítium li li+ a uhličitan anión32-. Jeho chemický vzorec je li2Co3. Li2Co3 Je to biela kryštalická tuhá látka, ktorú je možné získať reakciou medzi hydroxidom lítium a oxidom uhličitého.
Uhličitan lítium má veľmi vysoký bod fúzie, takže sa používa pri príprave skla, keramiky a porcelánu. Má veľmi rozmanité použitie, ako sú nabíjateľné lítiové batérie, pri príprave iných lítiových zlúčenín, zváracích elektród a maľieb a lakov.
 Uhličitan lítium Li2Co3 tuhý. Obrázok, ktorý urobil W: User: Walkerma v júni 2005. Zdroj: Wikimedia Commons.
Uhličitan lítium Li2Co3 tuhý. Obrázok, ktorý urobil W: User: Walkerma v júni 2005. Zdroj: Wikimedia Commons. Li sa tiež používa2Co3 V zmesiach cementu na dosiahnutie rýchleho prostredia a výroby hliníka.
Jedným z najdôležitejších použití je liečenie niektorých duševných chorôb, ako je depresia a nadmerne agresívne správanie, okrem iného.
Jeho používanie ako liek však musí riadne kontrolovať lekárski špecialisti, pretože ľudia liečení Li2Co3 Môžu trpieť škodlivými účinkami na zdravie, ako je hypotyreóza (znížená funkcia štítnej žľazy).
[TOC]
Štruktúra
Uhličitan lítium sa skladá z dvoch lítium Li+ a uhličitan anión32-.
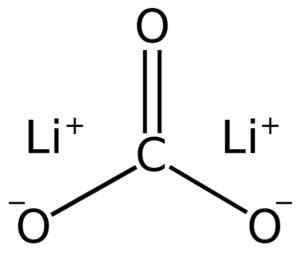 Štruktúra uhličitanu lítium lii2Co3. Adrian Hands [verejná doména]. Zdroj: Wikimedia Commons.
Štruktúra uhličitanu lítium lii2Co3. Adrian Hands [verejná doména]. Zdroj: Wikimedia Commons. Elektronická konfigurácia lítia v oxidačnom stave +1 je 1s2 2s0, Stratil elektrón poslednej vrstvy, a tak bol stabilnejší. Uhličitan ión CO32- Má plochú konštrukciu.
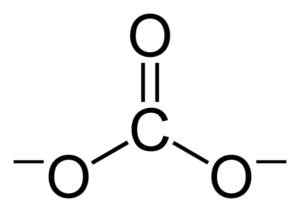 Plochá štruktúra uhoľného iónu CO32-. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons.
Plochá štruktúra uhoľného iónu CO32-. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons. Záporné zaťaženie je rozdelené rovnako medzi tri atómy kyslíka uhoľného iónu CO32-.
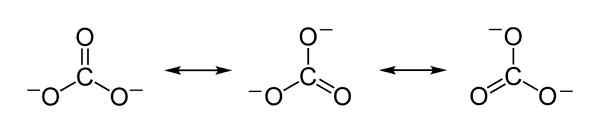 Teoretické rezonančné štruktúry uhličitanových iónov CO32- ktoré slúžia na vysvetlenie spravodlivého rozdelenia záporného zaťaženia medzi 3 atómami kyslíka. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons.
Teoretické rezonančné štruktúry uhličitanových iónov CO32- ktoré slúžia na vysvetlenie spravodlivého rozdelenia záporného zaťaženia medzi 3 atómami kyslíka. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons. Menovanie
-Uhličitan lítium
-Uhličitan
Fyzikálne vlastnosti
Fyzický stav
Kryštalická biela pevná látka monoklinickej štruktúry
Molekulová hmotnosť
73,9 g/mol
Bod topenia
723 ° C
Rozklad
Rozkladá sa pri 1300 ° C.
Hustota
2,11 g/cm3
Rozpustnosť
Malé rozpustné vo vode: 1,31 % hmotnosti pri 20 ° C. Jeho rozpustnosť vo vode klesá so zvyšovaním teploty. Je rozpustný v zriedených kyselinách. Je nerozpustný v alkoholu a acetóne.
Môže vám slúžiť: oxid bárnatého (BAO): Štruktúra, vlastnosti, použitia, rizikápH
Vodné roztoky sú zásadné, majú pH viac ako 7.
Chemické vlastnosti
Li2Co3 Je hydrolyzovaný vo vodnom roztoku, ktorý vytvára základný roztok. Malý podiel zlúčeniny, ktorá je solubilizovaná vo vode, opúšťa uhličitan anión32-.
Uhličitan anión32- Voľné vo vodnom roztoku si vyžaduje protón na vytvorenie aniónu hydrogenuhličitanu HCO3-, Ako je vidieť v nasledujúcej reakcii:
Co32- + H2O → HCO3- + Oh-
Prítomnosť OH iónov- To je to, čo robí riešenie základným.
Biologické vlastnosti
V zvieracích a ľudských tkanivách sú zvyčajne stopy s lítiom, ale až do okamihu, keď nie je známa prírodná fyziologická úloha tohto iónu.
V ľudskom organizme Li2Co3 Požiadané ako lieky pôsobí na rôzne signalizačné mechanizmy v neurónoch a iných bunkách. Výsledkom je nahradenie katiónov, ako je sodík a draslík.
Začlenenie lítium iónu do štruktúry bunkovej membrány môže zmeniť reakciu na hormóny a bunkové spojenie s energetickými procesmi.
Týmto spôsobom lítium modifuje niekoľko bunkových procesov vrátane metabolizmu.
Modifikáciou spôsobu, akým bunky fungujú2Co3 Môžete konať v komunikačných mechanizmoch neurónov v mozgu.
Získanie
Li2Co3 Môže sa získať reakciou hydroxidu lítium s oxidom uhličitým CO2, Ako je ukázané nižšie:
2 lioh + co2 → Li2Co3 + H2Ani
Komerčne sa vyskytuje z minerálov, ktoré obsahujú lítium, ako je Spodumen a lepidolit. Tieto minerály sú ošetrené pri vysokých teplotách s určitými sulfátovými soľami alebo alkalickými zlúčeninami, aby sa získali lítiové solí.
Získané lítiové soli sa čistia vodnými alebo kyslými roztokmi a potom sú ošetrené uhličitanom za vzniku li2Co3.
Li však2Co3 Týmto spôsobom je kontaminovaný sulfátmi alebo chloridmi vápenatý, horčík, železo, sodík, draslík atď. Vyžadujte teda následné čistenie.
Žiadosti
Pri liečbe duševných chorôb
Používa sa ako antimiánsky agent antimanicu, pri liečbe agresívne impulzívneho správania a bipolárnych porúch (ľudia, ktorí náhle menia svoj humor bez akejkoľvek príčiny, sa stávajú násilnými).
Môže vám slúžiť: 20 príkladov chemickej sublimácie a charakteristík Niektoré agresívne impulzívne poruchy sa môžu liečiť Li2Co3. Autor: Prawny. Zdroj: Pixabay.
Niektoré agresívne impulzívne poruchy sa môžu liečiť Li2Co3. Autor: Prawny. Zdroj: Pixabay. Lekári pozorovali, že ich podávanie vedie k zníženiu intenzity a frekvencie závažných období depresie a manických epizód.
Používa sa samostatne, tj bez pridanej zlúčeniny, pri udržiavacej terapii unipolárnej depresie a pri schizoecifickej poruche. Slúži tiež na zvýšenie antidepresívneho účinku iných liekov.
Aj keď sa používa na liečbu detí so zjavnými príznakmi bipolárnej poruchy a hyperaktivity neurotickými alebo agresívnymi zložkami, vo všetkých prípadoch nebola účinná.
Pri liečbe príznakov iných chorôb
Používa sa na zníženie frekvencie silných bolesti hlavy, opakujúce sa a chronické.
Používa sa na zníženie výskytu infekcie u pacientov s neutropéniou vyvolanou chemoterapiou alebo inými dôvodmi. Neutropénia je pokles neutrofilov, typ bielych krviniek, ktoré pomáhajú bojovať proti infekciám v tele.
Používa sa ako inhibítor enzýmu štítnej žľazy na liečbu hypertyreózy, ale nie je preferovanou liečbou kvôli jeho nepriaznivým účinkom.
Forma správy
Používa sa vo forme tabletov alebo kapsúl Li2Co3. Tiež v tabletoch s pomalou releasom s citrátmi lítium. Li je preferovaný2Co3 Pretože pri prehĺtaní nedráždi hrdlo, ako sa to stáva pri iných lítiových solí.
 Autor: Pete Lyforth. Zdroj: Pixabay.
Autor: Pete Lyforth. Zdroj: Pixabay. Nepriaznivé účinky
Li2Co3 Môže mať škodlivý vplyv na štítnu žľazu a obličky, takže funkcia týchto orgánov sa musí monitorovať pred a počas liečby touto zlúčeninou.
Li2Co3 Môže byť toxický pri koncentráciách veľmi blízko k koncentráciám používaným pri lekárskych ošetreniach, takže je potrebné nepretržité preskúmanie hodnoty ich krvného séra.
Li Otrava príznaky2Co3 Sú to chvenie, svalové kŕče, svalová slabosť, hnačka, zvracanie, ospalosť alebo ataxia (zhoršenie koordinácie svalov), okrem iného.
Na začiatku lirapie2Co3 Môžu sa vyskytnúť aj príznaky, ako sú tras, bolesti hlavy a nevoľnosť. Ale tieto majú tendenciu zmiznúť pokračujúcimi liekmi.
Môže vám slúžiť: HolmioVäčšina ošetrených ľudí môže tiež vyvinúť leukocytózu (zvýšenie počtu bielych krviniek), ale je to reverzibilné.
Ľudia, ktorí sú liečiví s Li2Co3 Nemali by manipulovať s vozidlami alebo prevádzkovať stroje, pretože znižuje fyzickú koordináciu a schopnosť vykonávať činnosti, ktoré je potrebné upozorniť.
Prípady, v ktorých by sa nemalo podávať
Nemalo by sa používať u detí do 12 rokov, pretože môže narušiť tvorbu kostí a ich hustotu, pretože mení koncentrácie hormónu štítnej žľazy. Má tiež tendenciu zaberať miesto vápnika v kostiach.
Nemali by sa s nimi zaobchádzať s li2Co3 Ľudia s kardiovaskulárnymi chorobami, obličkami alebo štítnou žľazou. Ani u ťažko dehydratovaných pacientov.
Tehotné ženy by sa nemali podávať najmä počas prvého trimestra tehotenstva. Lítium prechádza placentou a môže ľahko dosiahnuť plod s možnými teratogénnymi účinkami, to znamená, že môže produkovať anomálie alebo malformácie u pivovarníctva dieťaťa.
Starší ľudia, ktorí požadujú liečbu s Li2Co3 Mali by sa liečiť s veľkou starostlivosťou a dávkami nižšími ako dávky mladých dospelých, pretože sa môžu vyvinúť hypotyreózová choroba.
Iné použitia
Li2Co3 Vysoká čistota sa široko používa pri výrobe lítium nabíjateľných batérií.
Používa sa v roztavených uhličitanových palivových článkoch.
Používa sa na výrobu elektrického porcelánu, ktorý je typom porcelánu izolácie elektrickej energie. Používa sa tiež pri výrobe zasklenia na keramiku.
 Li2Co3 Používa sa na výrobu elektrického porcelánu, ktorý sa používa ako izolátor elektrickej energie, napríklad v elektrických výkonových stĺpoch. FIR0002 Flagstoffotos [at] gmail.Com Canon 20D + Tamron 28-75 mm f/2.8 [GFDL 1.2 (http: // www.GNU.Org/licencie/staré licenky/FDL-1.2.html)]. Zdroj: Wikimedia Commons.
Li2Co3 Používa sa na výrobu elektrického porcelánu, ktorý sa používa ako izolátor elektrickej energie, napríklad v elektrických výkonových stĺpoch. FIR0002 Flagstoffotos [at] gmail.Com Canon 20D + Tamron 28-75 mm f/2.8 [GFDL 1.2 (http: // www.GNU.Org/licencie/staré licenky/FDL-1.2.html)]. Zdroj: Wikimedia Commons. Umožňuje prípravu keramiky s nízkym expanzným koeficientom, to znamená, že pri zvyšovaní teploty rozširuje veľmi málo, takže keramika sa môže použiť vo vyššom intervale teploty.
Iné z jeho použití sú ako katalyzátor, pri výrobe iných lítiových zlúčenín, ako sú zváracie elektródy, vo vzorcoch luminiscenčných farieb, lakovaných lak.
Je užitočný na generovanie rýchlejšieho nastavenia cementu a pridáva sa do lepidla dlaždíc, aby sa dali opraviť v krátkom čase.
 Autor: CAPRI23AUTO. Zdroj: Pixabay.
Autor: CAPRI23AUTO. Zdroj: Pixabay. Odkazy
- Cai, w. a kol. (2018). Odstránenie SO42- z Li2Co3 rekryštalizáciou v NA2Co3. Crystals 2018, 8, 19. MDPI sa zotavila.com.
- Gadikota, G. (2017). Spojenie morfologických a kryštálových štrukturálnych zmien počas konverzie monohydrátu hydroxidu lítium s uhličitanom lítium pomocou viacúrovňového rôntgenového rozptylu rozptylu. Minerály 2017, 7, 169. MDPI sa zotavila.com.
- Alebo.Siež. Lekárska knižnica. (2019). Uhličitan lítium. Získané z: pubchem.Ncbi.NLM.NIH.Vláda.
- Kirk-Othmer (1994). Encyklopédia chemickej technológie. Štvrté vydanie. John Wiley & Sons.
- Ullmannova encyklopédia priemyselnej chémie. (1990). Piaty vydanie. VCH Verlagsgellschaft MBH.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- « Vnútorné a vonkajšie konjugované uhly príklady, cvičenia
- .Kyselina stearová (CH3 (CH2) 16COOH) Štruktúra, vlastnosti, používa »

