Kalmodulínová štruktúra, funkcie a mechanizmus pôsobenia
- 1871
- 333
- Tomáš Klapka
Kalmodulin Je to termín, ktorý znamená „proteín modulovaný vápnikom“ a označuje malý intracelulárny proteín, ktorý vlastní vlastnosť vápnikových iónov (Ca ++) a sprostredkuje mnohé z jeho intracelulárnych účinkov. Pôvod slova sa rodí z kombinácie anglických slov „vápnikových“, „modulovaných“ a „proteín“, ktoré, keď spolu, odvodzuje v VápnoCIUM ModulProtestV.
Medzi minerálnymi prvkami, ktoré sa stali súčasťou ústavy živočíšnych organizmov, vápnik, po ktorom nasleduje fosfor, je veľmi odlišný od tých najhojnejších, pretože z toho sa tvorí kosť vo svojej matrici veľkých množstiev minerálnych solí. ión.
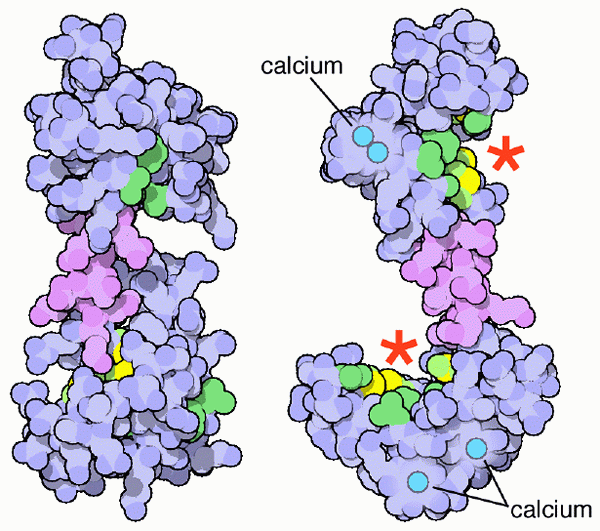
 Kalmodulínová schéma a jej miesta pre vápnikové odbory (zdroj: PDB [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons)
Kalmodulínová schéma a jej miesta pre vápnikové odbory (zdroj: PDB [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons) Tieto minerálne soli vápenatých sú samozrejme nevyhnutné pre ústavu a konformáciu kostrového systému stavovcov, ale je to ionizovaná forma vápnika (Ca ++) v roztoku v telesných tekutinách, ktoré sa stávajú fyziologickým významom relevantným pre životnosť Život organizmov.
Táto katión s dvoma pozitívnymi elektrickými nábojmi vo svojej štruktúre môže pôsobiť ako súčasný dopravník pri pohybovaní bunkovou membránou a modifikovať jej úroveň elektrického potenciálu v mnohých excitačných bunkách tela, hlavne v srdcovom svale.
Ale väčší fyziologický význam je skutočnosť, že mnoho bunkových regulačných reakcií vystrelených vonkajšími stimulmi, ako sú neurotransmitery, hormóny alebo iné fyzikálne alebo biochemické faktory, sú druhy metabolických vodopádov, na ktorých sa niekoľko proteínov postupne zúčastňuje, z ktorých niektoré sú enzýmy, ktoré sú enzýmami To sú enzýmy, ktoré sú enzýmami, ktoré vyžadujú vápnik na aktiváciu alebo inaktiváciu.
V týchto prípadoch sa potom hovorí, že vápnik pôsobí ako druhý posol v metabolickom vodopáde zameraným na dosiahnutie konečného výsledku, ktorý by sa stal potrebnou reakciou buniek na uspokojenie potreby zistenej na inej úrovni inej ako samotnej bunky, a ktorá od nej vyžaduje tá konkrétna odpoveď.
Vápnik môže pôsobiť priamo na svoj biochemický cieľ, aby ovplyvnil jeho aktivitu, ale často si vyžaduje účasť proteínu, s ktorým musí byť zjednotený, aby bol schopný uplatniť svoj účinok na proteíny (proteíny) na modifikáciu. Kalmodulín je jedným z tých sprostredkovateľských proteínov.
[TOC]
Štruktúra
Kalmodulín, s veľkou všadeprítomnosťou, pretože je exprimovaný takmer vo všetkých typoch buniek eukaryotických organizmov, je to malý kyslý proteín s molekulovou hmotnosťou asi 17 kDa, ktorého štruktúra je extrémne zachovaná medzi týmito druhmi.
Môže vám slúžiť: iónové kanály: štruktúra, funkcie, typyJe to monomérny proteín, ktorý je tvorený jediným polypeptidovým reťazcom, ktorý prijíma na svojom termináli konce tvaru guľových domén, ktoré sa navzájom spájajú s vrtuľou alfa alfa. Každá guľová doména má dva dôvody známe ako ef ruka (z angličtiny Ef Ručný), ktoré sú typické pre proteíny, ktoré sa viažu na vápnik.
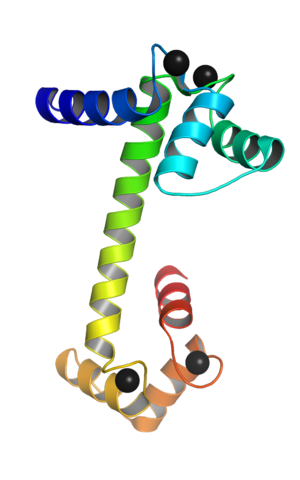 Kalmodulín spojený s vápnikovými iónmi (zdroj: Webridge [CC BY-SA (https: // creativecommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons)
Kalmodulín spojený s vápnikovými iónmi (zdroj: Webridge [CC BY-SA (https: // creativecommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons) Tieto topologické motívy „EF“ predstavujú určitý druh štruktúr SuperSecundaria; Sú navzájom spojené, v každej guľkovej doméne, regiónom s veľkou flexibilitou a v každom z nich je pre Ca ++ miesto spojenia, ktoré pre každú molekulu kalmodulínu hodí celkom 4 miesta.
Únia vápnikových iónov s pozitívnym zaťažením je možné vďaka prítomnosti aminokyselinového odpadu s laterálnymi reťazcami negatívne nabitými na miestach vápnikového únie kalmodulínového vápnika. Tento odpad sú tri aspartáty a glutamát.
Kalmodulínové funkcie
Všetky doteraz známe pre kalmodulín sú orámované v skupine akcií podporovaných zvýšením cytosolického vápnika produkovaného jeho vchodom z extracelulárneho priestoru alebo jeho výstupom z intracelulárnych ložísk: mitochondrie a endoplazmatické retikula.
Mnohé z akcií vápnika sú splnené týmto iónom pôsobiacim priamo na svoje biele proteíny, ktoré môžu mať rozmanitú povahu a funkcie. Niektoré z týchto proteínov nemožno priamo ovplyvniť, ale vyžadujú, aby sa vápnik pripojil k kalmodulínu a práve tento komplex pôsobí na proteín ovplyvnený iónom.
Hovorí sa o týchto bielych proteínoch, ktoré sú závislým vápnikovým kalmodulínom, a medzi nimi desiatky enzýmov, ako sú proteíny, proteinfosfáza, nukleotidové cyklasy a fosfodiesterázy; Všetky zapojené do nespočetných fyziologických funkcií, ktoré zahŕňajú:
- Metabolizmus
- Prenos častíc
- Viscerálna mobilita
- Sekrécia návykových látok
- Oplodnenie vajíčok
- Genetická expresia
- Proliferácia buniek
- Štrukturálna integrita buniek
- Medzibunková komunikácia atď.
Medzi citované proteíny závislé od kalmodulínu sú citované: ľahký reťazec myozínu (MLCK), fosforyláza CASE a Ca ++/Calmodulín Cinasa I, II a III.
Informácie kódované vápnikovými signálmi (zvýšenie alebo zníženie jeho intracelulárnej koncentrácie) sú teda „dešifrované“ týmto a ďalšími proteínmi vápnikového zväzu, vďaka čomu sú signály biochemické zmeny; Inými slovami, kalmodulín je sprostredkovateľský proteín v signalizačných procesoch závislých od vápnika.
Môže vám slúžiť: GLUS 2: Charakteristiky, štruktúra, funkcieMechanizmus akcie
Kalmodulín je veľmi univerzálny proteín, pretože jeho „cieľové“ proteíny sú značne rozmanité vo forme, sekvencii, veľkosti a funkcii. Pretože je to proteín, ktorý funguje ako „senzor“ vápnikových iónov, jeho mechanizmus pôsobenia závisí od zmien vyvolaných v jej štruktúre a/alebo konformácii, keď sa spojí štyri z týchto iónov.
Jeho mechanizmy pôsobenia sa dajú príkladom stručne preskúmaním ich účasti na niekoľkých fyziologických procesoch, ako je kontrakcia viscerálneho hladkého svalstva a prispôsobenie sa vôňam, ktoré trpia nosnými bunkami čuchovej sliznice v nose.
Kalmodulín a kontrakcia hladkého svalstva
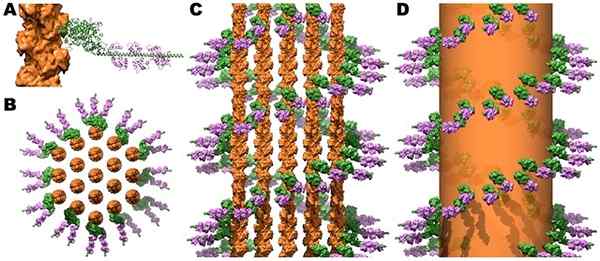 Štruktúra myozínových krížových mostov a kalmodulínu v mikrovelových aktínskych lúčoch. Zdroj: Jeffrey W. Hnedá, c. James McKnight [CC Autor (https: // creativecommons.Org/licencie/o/3.0)]
Štruktúra myozínových krížových mostov a kalmodulínu v mikrovelových aktínskych lúčoch. Zdroj: Jeffrey W. Hnedá, c. James McKnight [CC Autor (https: // creativecommons.Org/licencie/o/3.0)] Kontrakcia kostrových a srdcových svalov sa spustí, keď zvýšenie cytosolického Ca ++ dosiahne hladiny nad 10-6 mol/l a tento ión sa viaže na troponín C, ktorý sa podrobuje zmenám na osterické, ktoré ovplyvňujú tropomiozínozínozínozínozínozín. Na druhej strane sa tropomiozín pohybuje a odhaľuje na základe svojich miest Únie s myozínom a odvodzuje, že kontraktný proces spúšťa.
V hladkom svale nie je troponín C a zvýšenie Ca ++ nad označenou úrovňou podporuje jeho spojenie s kalmodulínom. Ca-kalmodulínový komplex aktívny s ľahkým reťazcom myozínu (MLCK), ktorý zase fosforyluje tento ľahký reťazec, aktivuje myozín a spúšťa kontraktilný proces.
Zvýšenie Ca ++ je dané vchodom z vonkajšej strany alebo výstupom zo sarkoplazmatického retikula pôsobením inozitol trypfosfátu (IP3) uvoľňovaného fosfolipázou C vo vodopáde aktivovanom receptormi spojenými s proteínom GQ proteín. Relaxácia nastane, keď sa Ca ++, transportnou akciou, odstráni z cytosolu a vráti sa na svoje zdrojové miesta.
Dôležitým rozdielom medzi oboma typmi kontrakcie je to, že v pruhovaných svaloch (srdcových a kostrových) Ca ++ indukuje astherické zmeny pri spájaní jeho proteínu, troponínu, zatiaľ čo v hladkých zmenách sú zmeny produkované ca-kalmodulínom kovalentné a naznačujú naznačovať fosforyláciu myozínu.
Preto po dokončení akcie Ca ++ sa vyžaduje účasť iného enzýmu, ktorý odstraňuje fosfát pridaný cinasou. Tento nový enzým je fosfatázou ľahkého reťazca myozínu (MLCP), ktorého aktivita nezávisí od kalmodulínu, ale je regulovaná inými cestami.
V skutočnosti sa proces kontraktilného hladkého svalstva neprestane, ale stupeň kontrakcie sa udržiava na strednej úrovni, ktorá má za následok rovnováhu pôsobenia oboch enzýmov, MLCK kontrolovaného Ca ++ a kalmodulínom a MLCP sa podrobil inému iným regulačné kontroly.
Môže vám slúžiť: pachyneAdaptácia v čuchových senzoroch
Zapálenie pocitu sa spúšťa, keď sa aktivujú čuchové receptory umiestnené v riasenke buniek umiestnených na povrchu čuchovej sliznice.
Tieto receptory sú spojené s heterotrofickým G proteínom známym ako „golf“ (G Olfactory Protein), ktorý má tri podjednotky: „αolf“, „ß“ a „γ“.
Keď sú čuchové receptory aktivované v reakcii na vôňu, disociované podjednotky tohto proteínu sú disociované a podjednotka „afol“ aktivuje adenylklasový enzým, ktorý produkuje adenozínový cyklický monofosfát (AMPC).
AMPC aktivuje kanály typu CNG (aktivované cyklickými nukleotidmi) pre vápnik a sodík. Tieto ióny vstupujú do bunky, depolarizujú ju a spôsobujú začiatok akčných potenciálov, ktorých frekvencia určí intenzitu zápachu.
Vápnik, ktorý vstupuje, ktorý má tendenciu depolarizovať bunku, má antagonistický účinok negatívnej spätnej väzby, o niečo neskôr, spojením kalmodulínu a medzi nimi zatváraním kanála a eliminovaním depolarizačného stimulu, napriek tomu, že zápachový stimul pretrváva. Toto sa nazýva adaptácia senzorov.
Kalmodulín v rastlinách
Rastliny tiež reagujú na rozdiely intracelulárnej koncentrácie od vápnikových iónov pomocou kalmodulínového proteínu. V týchto organizmoch zdieľajú kalmodulíny mnoho štrukturálnych a funkčných charakteristík so svojimi náprotivkami u zvierat a kvasiniek, hoci sa líšia v niektorých funkčných aspektoch.
Napríklad kalmodulín v rastlinách spája krátke peptidové sekvencie vo svojich bielych proteínoch, čo indukuje štrukturálne zmeny, ktoré menia ich aktivity v reakcii na vnútorné variácie vápnika.
Do akej miery kalmodulínové kontroly v rastlinách Analogické procesy, ku ktorým sa vyskytujú u zvierat, je niečo, čo je dnes predmetom diskusie.
Odkazy
- Brenner B: Musculatur, in: Fyziológia, 6. vydanie; R Klinke a kol. (Eds). Stuttgart, Georg Thieme Verlag, 2010.
- Ganong WF: Molekulárny základ lekárskej fyziológie, In: In: Preskúmanie lekárskej fyziológie, 25. vydanie. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall Ji: Úvod do endokrinológie, v: Učebnica lekárskej fyziológie, 13. Ed, AC Guyton, JE Hall (eds). Philadelphia, Elsevier Inc., 2016.
- Kaup UB, Müller F: Olfactorisches System, In: Physiologie, 4. vydanie; P Deetjen a kol. (Eds). München, Elsevier GmbH, Urban & Fischer, 2005.
- Korbmacher C, Greger R, Brenner B, Silbernagl S: Die Zelle ALS Grundbaustein, In: Fyziológia, 6. vydanie; R Klinke a kol. (Eds). Stuttgart, Georg Thieme Verlag, 2010.
- Zielinski, r. A. (1998). Kalmodulín a proteíny viažuci sa na kalmodulín v rastlinách. Ročný prehľad biológie rastlín, 49 (1), 697-725.

