História Boraxu, štruktúra, vlastnosti, použitie, syntéza, riziká

- 2854
- 572
- Gabriel Bahna
On Bór s sodným Je to nominálna hodnota pre skupinu chemických zlúčenín so základným vzorcom NA2B4Ani7. Je to hygroskopická soľ schopná tvoriť početné hydráty, okrem štrukturálneho obohacovania sa prítomnosťou určitých nečistôt kovov.
Hlavné zlúčeniny, ktoré sa nazývajú borax, sú nasledujúce: anhydro tetraborát sodný, na2B4Ani7; Pentahydráty tetraborát sodného (NA2B4Ani7).5H2Buď; a tetraborate sodný, na2B4Ani7.10 hod2Alebo, alebo jeho ekvivalent, oktahydráty tetraborát sodný, na2B4Ani5(Oh)4.8h2Ani.
 Fragment boraxu. Zdroj: Leon Hupperichs [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Fragment boraxu. Zdroj: Leon Hupperichs [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Ako je zrejmé, všetky predchádzajúce pevné látky sa líšia iba v ich stupni hydratácie; Niektoré majú vo svojich kryštáloch viac molekúl vody ako iné. Fyzicky borax je podobný kusom alebo robustným kryštálom kriedy (vynikajúci obraz).
Borax sa prirodzene nachádza v sedimentoch sezónnych jazier, vysušených odparovaním. Borax sa vyskytuje v Turecku, Searles Lakes (Kalifornia), v Atacama, Čile, Bolívia, Tibet a Rumunsko púšte. Synteticky sa môžu kryštály boraxu získať pomocou pomalého procesu nukleácie; to znamená, v ktorom sa uprednostňuje rast kryštálov.
Sodík, bezvodé a rozpadajúce tetraborát sú malé rozpustné v studenej vode; ale jeho rozpustnosť sa zvyšuje so zvýšením teploty. Potom2B4Ani7.10 hod2Alebo je veľmi rozpustný v etylénglykole, mierne rozpustný v etanolu a malý rozpustný v acetóne; Jedná sa o menej polárnych rozpúšťadiel ako voda.
Borax má početné aplikácie, napríklad pri vypracovaní detergentov a mydiel; ako oneskorenie ohňa celulózového materiálu; pri výrobe zo sklenených vlákien; pri čistení tvrdých povrchov, ako sú kovy, sklo a keramika; a pri inhibícii korózie, okrem iného.
Borax dráždi oči, pokožku a dýchací trakt. Požitím môže vyvolať okrem iných príznakov, zvracanie, hnačky, ochabnutie, rozpad a záchvaty. V súčasnosti sa predpokladá, že škodlivé účinky na reprodukciu človeka môžu mať.
[TOC]
História
História boraxu je mätúca. Zdôrazňuje sa, že bol objavený v posteli jazera Tibet, vysušený odparovaním. Bola prenesená v siedmom storočí Tibetu do Saudskej Arábie po So -Called Silk Trase.
Termín „Borax“ bol populárny po početných aplikáciách, ktoré boli nájdené a uvádzané na trh pod menom 20 Mule Team Borax Tradermax, ktoré sa týkali spôsobu, akým bol borax prepravovaný púštmi Nevada a Kalifornie.
Ďalšia verzia ich objavu naznačuje, že Egypťania poznali svoju existenciu už dlho, pričom ju používali vo zvaroch kovov pomocou tepla. Okrem toho ho používali v medicíne a v procese mummifikácie. Borax bol prevezený do Európy v trinástom storočí Marco Polo.
V polovici až 9. storočia sa v púšti Magove objavili veľké ložiská borax.
Štruktúra boraxu
 Štruktúra boraxu. Zdroj: Smokefoot [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Štruktúra boraxu. Zdroj: Smokefoot [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Vynikajúci obrázok zobrazuje ióny, ktoré tvoria borax, špecificky zodpovedajúce pevnej látky s kompozičným vzorcom Na2[B4Ani5(Oh)4] · 8h2Alebo (alebo na2B4Ani7· 10h2Buď).
Po prvé, je možné si všimnúť štruktúru aniónu v klietke [b4Ani5(Oh)4]2- (Aj keď by som mal mať dve skupiny-), v ktorom je možné vidieť osemuholníkový prsteň (štyri atómy B a štyri O)), s mostom B-O-B, ktorý ho rozdelí na dve polovice.
Môže vám slúžiť: Alkalické riešenia: Definícia, vlastnosti a použitiaTáto klietka nezostáva statická, ale vibruje a prijíma rôzne konformácie vo vesmíre; V menšej miere v blízkosti mosta. Je tiež možné poznamenať, že je veľmi „okysličený“; To znamená, že má veľa atómov kyslíka, schopných interagovať s molekulami vody pomocou vodíkových mostov.
Nie je prekvapujúce, že kryštály boraxu môžu hydratovať a generovať početné hydráty. Tak pre pevné Na2[B4Ani5(Oh)4] · 8h2Alebo je tu osem h molekúl2Alebo interakcia s klietkou Borarate a zároveň s kovovými centrami NA+.
Na strane katiónu máte vodný komplex [na (h (h2Buď)4]+n, kde hodnota n bude závisieť od pomeru aniónov/katiónov. V hornej pevnej látke, n = 2, takže máte: [na2(H2Buď)8]2+, ktorého zaťaženie 2+ neutralizuje zaťaženie 2- aniónu Borarate.
Kryštály
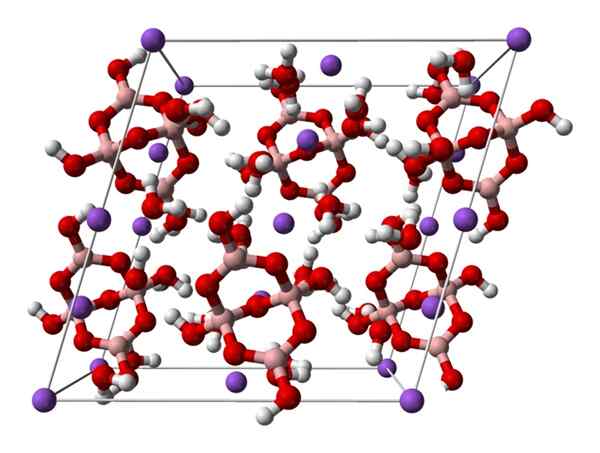 Borax monoklinická bunka. Zdroj: Ben Mills [verejný
Borax monoklinická bunka. Zdroj: Ben Mills [verejnýDoména].
Nahor2[B4Ani5(Oh)4] · 8h2Alebo na2B4Ani7· 10h2Ani. Tu elektrostatické atrakcie a vodíkové mosty riadia alebo dominujú štrukturálnym vzorom vznikajúcim v každom skle skla.
Ostatné hydráty a bezvodá soľ stratia jednu alebo všetky svoje molekuly vody, čím sa zmení zloženie a štruktúra kryštálu boraxu. Vo všetkých z nich zostáva anión a katión rovnaké (pokiaľ neexistujú nečistoty alebo bočné reakcie), takže nie je možné vyvolať zmätok.
Zmätky s aniónom Boraato
Nat2[B4Ani5(Oh)4] · 8h2Alebo na2B4Ani7· 10h2Alebo sú rovnaké. Pretože?
Po prvé, ak sa spočítajú ich atómy, uvidia, že sa zhodujú v počte; A po druhé, v aninii B4Ani72- Zohľadňuje sa neprítomnosť dvoch skupín OH spojených s borónovými hlavami mostov B-O-B; dve, to, spolu s dvoma h+ z B4Ani72-, Pridajte až 2 h2Alebo, dávať celkom 10 h2O (8 + 2).
Vlastnosti
Mená
- Box.
- Búratý sodný.
- Tetraborát sodný.
- Uttabočený.
Molekulárna hmotnosť
Anhydro: 201,22 g/mol.
Dekorát: 381,38 g/mol.
Fyzický vzhľad
Kryštalická biela pevná látka.
Hustota
Bezvodý: 2,4 g/cm3
Derachixture: 1 739 g/cm3
Bod topenia
Anhidro: 743 ° C (1.369 ° F, 1.016 k).
Dekomydrát: 75 ° C.
Bod varu
Anhidro: 1.575 ° C (2.867 ° F, 1.848 k).
Rozpustnosť
31,78 g/l (pre bezvodých aj decayropera).
Rozpustnosť v organických rozpúšťadlách
Je veľmi rozpustný v etylénglykole, mierne rozpustný v dietylénglykole a metanole a mierne rozpustný v acetóne.
Index lom (ηd)
Anhidro: η1 = 1 447; η2 = 1 469.
Decayedrado: η2 = 1 472.
Stabilita
Je stabilný za primeraných podmienok skladovania. Aj keď má nízky tlak pary, zvyšuje sa s teplotou a spôsobuje kryštalizáciu a kondenzáciu, preto by sa malo vyhnúť nadmerným kolísaniam teploty a vlhkosti.
Ľahké emisie
Tetraborate sodný, keď je vystavený pôsobeniu ohňa, emituje zelené svetlo.
Reakcie
- Pri rozpustení vo vode sa alkalické roztoky pochádzajú z pH okolo 9,2.
- Borax reaguje na vytvorenie iných bormátov, ako je perborát (PBS).
- Pri reagovaní s kyselinou chlorovodíkovou tiež produkuje kyselinu boru:
Nat2B4Ani7· 10h2O + hcl => 4 h3Bož3 + 2 na+ + 2 cl- + 5 h2Ani
- Tetraborát sodný sa správa ako amfohete látka, pretože vo vodnom roztoku je hydrolyzovaný a je schopný neutralizovať kyselinu. Rovnakým spôsobom je schopný neutralizovať alkalis s vysokou koncentráciou, čím sa zabráni nadmernému zvýšeniu stredného pH.
Môže vám slúžiť: primárny alkohol: štruktúra, vlastnosti, nomenklatúra, príkladyŽiadosti
Borax má početné aplikácie v ľudskej bytosti, ako aj v súbore aktivít, ktoré vykonáva.
Antioxidačné pôsobenie
Borax má schopnosť rozpustiť oxidy. Z tohto dôvodu sa používa pri zotavovaní kovov, ako sú mosadz, meď, olovo a zinok.
Používa sa tiež na zabránenie oxidácie kovových tyčí v základoch. Borax pokrýva jeho povrch, s výnimkou vzduchu, a preto sa vyhýba oxidácii. Okrem toho zabraňuje korózii železného materiálu vo výrobe automobilov.
Rozpustnosť boraxu v etylénglykole bola užitočná vo formuláciách nemrznúca zmes. Borax neutralizuje kyslý odpad, ktorý sa vyrába počas rozkladu etylénglykolu, a minimalizuje oxidáciu, ktorú môže trpieť povrchom kovov.
Vypracovanie lepidiel
- Borax je súčasťou adhézneho škrobového formulácie pre vlnité papier a kartón.
- Je to pepdizačné činidlo pri výrobe lepidiel založených na kazeíne a dextríne.
- Akty posilňujú adhezívne materiály krížením konjugovaných skupín hydroxilov.
Spomaľovač horenia
Používa sa ako spomaľovač horenia v celulózových materiáloch a ďalších polyméroch obsahujúcich hydroxilli skupiny. Pôsobí svojím pôsobením niekoľkými mechanizmami vrátane tvorby sklovcovej vrstvy, ktorá obmedzuje prístup k palivám.
Borosilizované rozpracovanie skla (Pyrex)
Borax je zdrojom bóru používaného pri vypracovaní borosilizovaného skla; charakterizovaný vysokým bodom fúzie, nízkym expanzným koeficientom a vysokou odolnosťou voči tepelným šokom.
To vám umožní byť vystavený vysokým teplotám bez toho, aby ste zažili zlomeniny, prijali refraktérnu nominálnu hodnotu skla.
Borosilizované sklo sa používa pri vypracovaní materiálov, ktoré sa majú používať doma na pečenie potravín. Používa sa tiež v laboratóriu v kadičkách, fixáloch, valcoch, pipety atď.
Emulgátor
Borax, spolu s inými zlúčeninami, sa používa na emulgovanie mydiel a iných parafínov. Používa sa tiež ako základ pre vypracovanie pleťov, krémov a mastí.
Čistiaci materiál
- Pridá sa do formulácií na čistenie pevných povrchov, ako sú kovy, sklo a keramika.
- Používa sa v čističkách rúk, leštejúci. Okrem toho uľahčuje odstránenie mastných usadenín z podlahových tovární.
Lekárske použitie
- Používa sa pri liečbe infekcií húb nôh.
- Je súčasťou výživného vzorca, ktorý dodáva bóru. Predpokladá sa, že tento prvok zasahuje do metabolizmu vápnika, fosforu a horčíka, ktorý je potrebný pre kostnú štruktúru.
- Zasahuje do stanovenia glykozylovaného hemoglobínu (HBA1C), čo je dôkaz, ktorý slúži na poznanie vývoja dlhodobého diabetu u pacienta, pretože čas polovičného života erytrocytu je 120 dní.
Táto informácia je užitočnejšia pre lekára ako izolované stanovenia glukózy v krvi pacienta.
Tlmič na pH
Používa sa vo viacerých tlmich tlmičov pH používaných v biochémii; Medzi nimi je Tris (hydroxymetyl) aminometán-bory, ktorý sa používa pri elektroforéze v polyakrylamide DNA a RNA nukleových kyselín.
Zníženie tvrdosti vody
Borax je schopný kombinovať s vápnikovými a horčíkovými iónmi prítomnými vo vode, čím sa znižuje jej koncentrácia. Týmto spôsobom sa zníži tvrdosť vody.
Môže vám slúžiť: hydroxid draselný: štruktúra, vlastnosti, použitiaHnojivo
Borax sa používa ako zdroj bóru. Vápnik a bór sa podieľajú na tvorbe bunkovej steny rastlín. Okrem toho sa zdôraznilo, že Bór uprednostňuje opelenie, takže zasahuje do oplodnenia a šírenia rastlín.
Drevená ochrana
Borax bojuje s drevom, chrobákom, ktorý konzumuje a ničí drevo. Používa sa tiež na ochranu a údržbu drevených lodí.
Zakladanie
Používa sa ako zakladateľ v oceli a zváraní železa, čo spôsobuje zníženie bodu topenia a elimináciu oxidu železa; Nežiaduca znečisťujúca látka. S podobným koncom sa zúčastňuje na zváraní zlata a striebra.
Ďalší
- Používa sa ako mäkký pesticíd; Napríklad pre boj o moly vo vlne.
- Postriekané podávajú na kontrolu škodcov prítomných v skrinkách, vnútorných ložiskách, v medzerách stien a všeobecne, kde nie je potrebné používanie viac znečisťujúcich pesticídov.
- Používa sa v jadrových reaktoroch na kontrolné reakcie, ktoré by mohli v extrémnych prípadoch vyvolať reťazovú reakciu.
- V autách radiátory sa Borax používa na získanie miest, kde sú únik vody.
Syntéza
Borax sa získa reagom5Ani9.8h2Alebo s uhličitanom sodným a uhľovodíkom sodným vo vodnom médiu.
Syntéza tetraborátu sodíka alebo boraxu sa v skutočnosti používa málo; Väčšina produkovanej zlúčeniny sa získava extrakciou minerálov, ktoré ich obsahujú.
Tento proces je možné zhrnúť v roztoku rudy vo vode, po ktorom nasleduje ílová filtrácia a nakoniec odparovanie vodného roztoku.
Riziká
Borax je prírodný produkt, ale môže spôsobiť množstvo zdravotných škôd u ľudí. Napríklad v dôsledku kontaktu s prachovým prachom môže dôjsť k podráždeniu kože, ktorá by mohla spôsobiť dermatitídu.
Podobne Borax vyvoláva podráždenie očí a horných dýchacích ciest. Medzi príznakmi jeho vdýchnutia je bolesť kašľa a krku.
Medzitým príjem Borax predstavuje nasledujúce príznaky: zvracanie, nevoľnosť, hnačka, ochabnutie, bolesti hlavy a záchvaty. Okrem toho sa môže vyskytnúť atrakcia centrálneho nervového systému a funkcia obličiek.
Zo štúdií vykonaných u potkanov mužského pohlavia, kŕmených boraxom, bola pozorovaná semenná atrofia. Zatiaľ čo štúdie uskutočňované s tehotnými ženskými potkanmi poukázali na to, že Borax by mohol prekročiť placentu, čo by spôsobilo zmenu vývoja plodu, prejavenú nízkou pôrodnou hmotnosťou.
Predpokladá sa, že expozícia boraxu môže ovplyvniť reprodukčnú funkciu mužov u človeka, ktorá sa prejavuje znížením počítania spermií.
U dospelých sa odhaduje smrteľná dávka 10 až 25 gramov pre príjem boraxu u dospelých.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Národné centrum pre biotechnologické informácie. (2019). Argón. Databáza pubchem. CID = 23968. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Karolyn Burns, Seneca Joseph a Dr. Ryan Baumbach. (s.F.). Syntéza a vlastnosti boraxových kryštálov a intermetallových zliatin. Získané z: NationalMaglab.orgán
- Wikipedia. (2019). Box. Zdroj: In.Wikipedia.orgán
- Rio Tinto. (2019). Dehydrát boraxu. 20 Mule Team Borax. Získané z: Borax.com
- Fletcher Jenna. (14. januára 2019). Je borax bezpečný na použitie? Získané z: MedicalNewstody.com
- « Štruktúra chrómového chloridu (CRCL3), vlastnosti, použitie
- Transgénne charakteristiky potravín, výhody, príklady, dôsledky »

