Štruktúra chrómového chloridu (CRCL3), vlastnosti, použitie

- 2041
- 619
- MUDr. Miloslav Habšuda
On Chrómový chlorid (CRCL3) Je to anorganická soľ zložená z CR katiónov3+ a cl anióny- v pomere 1: 3; to znamená pre každú cr3+ Existujú tri CL-. Ako bude vidieť neskôr, ich interakcie nie sú iónové. Táto soľ sa môže vyskytnúť v dvoch formách: anhydra a hexahydrát.
Bezvodný tvar sa vyznačuje prezentáciou fialovo-redish sfarbenia; Zatiaľ čo hexahydrát, krik3.6H2Alebo je tmavo zelená. Začlenenie molekúl vody modifikuje fyzikálne vlastnosti týchto kryštálov; ako jeho varné a fúzne body, hustoty atď.
 Fialové kryštály chrómového chloridu (III) bezvodého. Zdroj: Ben Mills [verejná doména]
Fialové kryštály chrómového chloridu (III) bezvodého. Zdroj: Ben Mills [verejná doména] Chrómový chlorid (III) (podľa nomenklatúry zásob) sa rozkladá pri vysokých teplotách, pričom sa stáva chrómovým chloridom (II), Crcl2. Je korozívny pre kovy, hoci sa používa v chróme: postup, v ktorom sú kovy pokryté tenkou chrómovou vrstvou.
CR3+, Vychádzajúc z príslušného chloridu sa používa pri liečbe cukrovky, najmä u pacientov s celkovou parenterálnou výživou (TPN), ktorí nepochádzajú množstvo požadovaného chrómu. Výsledky sú však oveľa lepšie (a spoľahlivejšie), ak sa dodáva ako picolinato.
[TOC]
Chrómová štruktúra chloridu
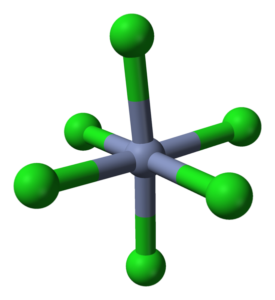 Octaedro koordinácia pre CRCL3 vo svojich kryštáloch. Zdroj: Ben Mills [verejná doména]
Octaedro koordinácia pre CRCL3 vo svojich kryštáloch. Zdroj: Ben Mills [verejná doména] Kričať3 Napriek tomu, že je to soľ, povaha ich interakcií nie je čisto iónová; Majú určitý kovalentný charakter, produkt koordinácie medzi CR3+ a cl-, ktoré vedú k deformovanému oktaedronu (vynikajúci obraz). Chróm sa nachádza v strede oktaedra a chloros na jeho vrcholoch.
Octaedron Crcl6 Na prvý pohľad môžete na prvý pohľad odporovať3; Tento kompletný oktadron však nedefinuje jednotkovú bunku skla, ale kocka (tiež zdeformovaná), ktorá prerezáva zelené gule alebo anióny chlóru na polovicu.
Môže vám slúžiť: 20 príkladov chemickej sublimácie a charakteristíkKryštalické vrstvy bezvodého
Unitárna bunka s týmto oktaedro teda naďalej udržiava pomer 1: 3. Reprodukovanie týchto deformovaných kociek vo vesmíre sa získa kryštál CRCL3, ktorý je zastúpený v vynikajúcom obrázku s trojrozmerným plnením a modelom guľôčok a tyčí.
 Vrstva kryštálovej štruktúry CRCL3 je znázornená s trojrozmernými guľami a stĺpcovými modelmi. Zdroj: Ben Mills [verejná doména]
Vrstva kryštálovej štruktúry CRCL3 je znázornená s trojrozmernými guľami a stĺpcovými modelmi. Zdroj: Ben Mills [verejná doména] Táto kryštalická vrstva je jednou z mnohých, ktoré vyrábajú3 (Nezamieňajte farbu skla, pravdivá, s farbou zelených guľôčok).
Ako je vidieť, anióny CL- Zaberajú povrch, takže ich záporné zaťaženia odpudzujú ostatné kryštalické vrstvy. V dôsledku toho sa kryštály stávajú podvodmi a krehké; Ale brilantné, kvôli chrómu.
Ak sa tieto rovnaké vrstvy vizualizujú z bočného hľadiska, bude pozorované namiesto oktaedry skreslené tetraheders:
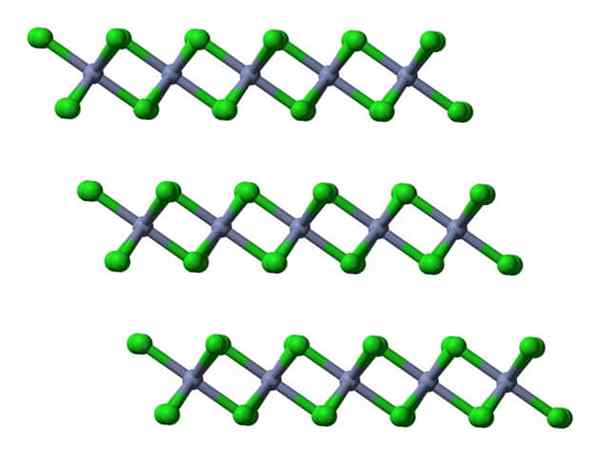 CRCL3 kryštalické vrstvy pohľady laterálne. Zdroj: Ben Mills.
CRCL3 kryštalické vrstvy pohľady laterálne. Zdroj: Ben Mills. Tu je pochopenie toho, prečo sú vrstvy navzájom odrazené, je uľahčené, keď CL- jeho povrchy.
Vlastnosti
Mená
-Chrómový chlorid (III)
-Chrómový trichlorid (III)
-Chrómový chlorid (III) bezvodý.
Chemický vzorec
-Kričať3 (bezvodý).
-Kričať3.6H2O (hexaking).
Molekulová hmotnosť
-158,36 g/mol (bezvodý).
-266,43 g/mol (hexahydrát).
Fyzický popis
-Pevné a fialovo-redistické kryštály (bezvodé).
-Tmavo zelený kryštalický prach (hexahydrát, dolný obrázok). V tomto hydráte je možné vidieť, že voda inhibuje jas, kovový chrómový prvok.
 Hexahydrát chrómový chróm. Zdroj: Používateľ: Walkerma [verejná doména]
Hexahydrát chrómový chróm. Zdroj: Používateľ: Walkerma [verejná doména] Bod topenia
-1.152 ° C (2.106 ° F, 1.425 K) (anhydrum)
-83 ° C (hexahydrát).
Bod varu
1300 ° C (2.370 ° F, 1.570) (anhydrum).
Rozpustnosť
 Vodné roztoky chrómového chloridu (III). Zdroj: Leiem [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Vodné roztoky chrómového chloridu (III). Zdroj: Leiem [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] -Mierne rozpustné (anhydro).
-585 g/l (hexahydrát).
Na hornom obrázku je zobrazená séria testovacích skúmaviek naplnených vodným roztokom CRCL3. Všimnite si, že čím koncentrovanejšia, tým intenzívnejšia je farba komplexu [Cr (OH2)6]3+, Zelená farba zodpovedná.
Môže vám slúžiť: Putrescina: Štruktúra, vlastnosti, syntéza, použitieRozpustnosť v organických rozpúšťadlách
Rozpustný v etanole, ale nerozpustný v éteri (bezvodý).
Hustota
-2,87 GR/CM3 (bezvodý).
-2,76 g/cm3 (Hexahydrát).
Úložisko
Rozklad
Keď sa zahrieva na rozklad, chróm chlorid (III) emituje toxické výpary zlúčenín obsahujúcich chlór. Tieto zlúčeniny sa uvoľňujú aj vtedy, keď chrómový chlorid (III) príde do kontaktu so silnými kyselinami.
Korózia
Je vysoko korozívny a môže zaútočiť na určité ocele.
Reakcie
Je nezlučiteľná so silnými oxidantmi. Tiež silne reaguje s lítiom a dusík.
Keď je zahrievaný v prítomnosti vodíka, redukuje sa na chrór chróm (II), s tvorbou chloridu vodíka.
2 CrCl3 + H2 => 2 Crcl2 + 2 HCl
pH
Vo vodnom roztoku as koncentráciou 0,2 m: 2,4.
Syntéza
Vyrába sa chrómový chlorid (III) hexahydrát, ktorý reaguje hydroxid chrómu s kyselinou chlorovodíkovou a vodou.
CR (OH)3 + 3 HCl +3 h2O => CrCl3.6H2Ani
Potom, aby sa získala anhydra soľ, CRCL sa zahrieva3.6H2Alebo v prítomnosti chloridu tionilo, SOCL2, kyselina chlorovodíková a teplo:
[Cr (H2Buď)6] Cl3 + 6sokl2 + ∆ → Crcl3 + 12 HCl + 6SO2
Prípadne Crcl3 Chlórový plyn sa získava na zmesi chrómu a oxidu uhlíka.
Cr2Ani3 + 3 C +Cl2 => 2 Crcl3 + 3 co
A nakoniec, ako najpoužívanejšou metódou, je zahrievaním oxidu halogenantným činidlom, ako je napríklad tetrachlorid uhlíka:
Cr2Ani3 + 3CCL4 + ∆ → 2Crcl3 + 3cocl2
Žiadosti
Priemyselný pracovník
Chrómový chlorid zasahuje do prípravy chrómového chloridu chrómu (II); Činidlo, ktoré zasahuje do redukcie alkylových halogenidov a pri syntéze haluróz (e) -salquenilu.
Môže vám slúžiť: oxalát sodný (Na2C2O4): Štruktúra, vlastnosti, použitia, riziká-Používa sa v technike chrómovanej. Toto spočíva v ukladaní, prostredníctvom galvanoplastiky, jemnej vrstvy chrómu na kovových objektoch alebo inom materiáli s dekoratívnym cieľom, čím sa zvyšuje odolnosť proti korózii a tiež povrchová tvrdosť.
-Používa sa ako textilný mordant a slúži ako spojenie medzi farbiacim materiálom a tkaninami, ktoré sa majú zafarbiť. Okrem toho sa používa ako katalyzátor na výrobu olefínov a hydroizolačných látok.
Terapeutika
Použitie doplnku chrómového chloridu U USP sa odporúča u pacientov, ktorí dostávajú iba intravenózne roztoky, podávané na celkovú parenterálnu výživu (TPN). Preto iba vtedy, keď títo pacienti nedostanú všetky svoje výživové požiadavky.
Chróm (III) je súčasťou faktora tolerancie glukózy, aktivátora reakcií podporovaných inzulínom. Predpokladá sa, že chróm (III) aktivuje metabolizmus glukózy, proteínov a lipidov, čo uľahčuje pôsobenie inzulínu u ľudí a zvierat.
Chróm je prítomný v mnohých potravinách. Ale jej koncentrácia nepresahuje 2 prideľovaním, pričom brokolica je jedlo s najväčším príspevkom (11 µg). Črevná absorpcia chrómu je navyše nízka, s hodnotou 0,4 až 2,5% požitého množstva.
To sťažuje zriadenie stravy na dodávku chrómov. V roku 1989 Národná akadémia vied odporučila ako primeraný príjem chrómu 50 až 200 µg/deň.
Riziká
Medzi možné riziká spotreby tejto soli ako chrómového doplnku patrí:
-Silné bolesti žalúdka.
-Abnormálne krvácanie, ktoré sa môže líšiť od ťažkostí na vyliečenie rany, červenej najprehliežky alebo stmavnutia fekálnej stolice produktu vnútorného krvácania.
-Podráždenie v tráviacom systéme, ktoré spôsobuje vredy alebo črevá žalúdka.
-Dermatitída
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2019). Chróm chlorid. Zdroj: In.Wikipedia.orgán
- Chróm (III) chlorid [PDF]. Získané z: Alpha.Chem.Unb.Edu
- Publikácia. (2019). Hexahydrát chrómu. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Národný inštitút zdravia. (21. september 2018). Chromium: SKLADOVÝ STRUČNÝ DODATOK. Zdroj: SDG.Odplaziť.NIH.Vláda
- Tomlinson Carole a. (2019). Vedľajšie účinky chromium chloridu. LEAF Group Ltd. Zotavené z: zdravého.com
- « Prečo je dôležité čítať? 10 výhod čítania
- História Boraxu, štruktúra, vlastnosti, použitie, syntéza, riziká »

