Rovnováha hmoty Čo je, všeobecná rovnica, typy
- 1505
- 134
- Tomáš Mydlo
On rovnováha Je to počet komponentov, ktoré patria do študovaného systému alebo procesu. Táto rovnováha sa dá uplatniť takmer na akýkoľvek typ systému, pretože sa predpokladá, že súčet hmotností takýchto prvkov musí zostať konštantný na rôzne merania meraní.
Podľa súčastiu pre guľky, baktérie, zvieratá, drevo, ingrediencie pre koláč; av prípade chémie, molekúl alebo iónov alebo konkrétnejšie zlúčeniny alebo látky. Potom musí zostať konštantná celková hmotnosť molekúl, ktoré vstupujú do systému, s chemickou reakciou alebo bez nich; Pokiaľ nedochádza k úniku straty.
V praxi sa uvádza nespočetné množstvo problémov, ktoré môžu ovplyvniť rovnováhu hmoty, okrem zohľadnenia rôznych javov hmoty a účinku mnohých premenných (teplota, tlak, prietok, miešanie, veľkosť reaktora atď.).
Na papieri sa však musia zhodovať výpočty rovnováhy záležitosti; to znamená, že hmotnosť chemických zlúčenín by nemala kedykoľvek zmiznúť. Vytváranie tejto rovnováhy je analogické, aby sa zostavilo hromadu hornín. Ak sa jedna z masy dostane z miesta, všetko sa rozpadá; V tomto prípade by to znamenalo, že výpočty sú nesprávne.
Všeobecná rovnováha s predmetom
V každom systéme alebo procese je potrebné najprv definovať, aké sú ich hranice. Z nich bude známe, do ktorých zlúčenín vstupujú alebo odchádzajú. Je vhodné to urobiť, najmä ak existuje viac procesných jednotiek, ktoré treba zvážiť. Ak sa uvažujú o všetkých jednotkách alebo subsystémoch, hovorí sa o súvahe všeobecnej hmoty.
Táto rovnováha má rovnicu, ktorá sa dá uplatniť na akýkoľvek systém, ktorý dodržiava zákon o zachovaní hromadnej ochrany. Rovnica je nasledovná:
Môže vám slúžiť: chlorid olovom: vlastnosti, štruktúra, použitieE + g - s - c = a
Kde e je množstvo hmoty vstupovať Do systému; G je to, čo viem vytvárať Ak v procese nastane chemická reakcia (ako v reaktore); S je čo vyjde systému; C je to, čo viem konzumovať, Opäť, ak existuje reakcia; A nakoniec, to je to, čo viem hromadiť sa.
Zjednodušenie
Ak je v systéme alebo procese, ktorý sa študuje, neexistuje žiadna chemická reakcia, G a C majú hodnotu nula. Rovnica teda zostáva:
E - s = a
Ak sa systém posudzuje aj v stacionárnom stave, bez výrazných zmien v premenných alebo tokoch komponentov, hovorí sa, že nič sa vo vnútri akumuluje. Preto má hodnotu nula a rovnica sa ešte viac zjednodušuje:
E = s
To znamená, že množstvo záležitostí, ktorá vstupuje, sa rovná tej, ktorá vyjde. Nič sa nemôže stratiť alebo zmiznúť.
Na druhej strane, ak dôjde k chemickej reakcii, ale systém je v stacionárnom stave, G a C budú mať hodnoty a budú naďalej nula:
E + g - s - c = 0
E + g = s + c
Čo znamená, že v reaktore sa hmotnosť reagencií, ktoré vstupujú, a výrobkov, ktoré v ňom generujú, sa rovná množstvu výrobkov a činidiel, ktoré vyjdú, a spotrebovaných činidiel.
Príklad jeho použitia: Ryby v rieke
Predpokladajme, že sa študuje počet rýb v rieke, ktorých banky prichádzajú na hranicu systému. Je známe, že v priemere 568 rýb ročne sa narodí 424 (generujte), 353 matrice (konzumáciu) a 236 emigrácií alebo odchodu.
Uplatňovanie všeobecnej rovnice, potom máte:
568 + 424 - 353 - 236 = 403
To znamená, že do 403 rýb sa hromadia v rieke; To znamená, že za rok rieka obohacuje viac rýb. Keby som mal zápornú hodnotu, znamenalo by to, že počet rýb klesá, možno na negatívne vplyvy na životné prostredie.
Môže vám slúžiť: iónová sila: jednotky, ako ho vypočítať, príkladyChlapci
Z všeobecnej rovnice si môžete myslieť, že existujú štyri rovnice pre rôzne typy chemických procesov. Zostatok hmoty je však rozdelený na dva typy podľa iného kritéria: čas.
Diferenciálna rovnováha
V rovnováhe diferenciálnej hmoty je množstvo komponentov v systéme v danom čase alebo čase. Tieto hmotnostné množstvá sú vyjadrené jednotkami času, a preto predstavujú rýchlosti; Napríklad kg/h, čo naznačuje, koľko kilometrov vstupuje, odchádza, akumuluje, generuje alebo konzumuje za hodinu.
Aby existujú hmotnosť (alebo objemové toky s hustotou), systém musí byť všeobecne otvorený.
Integrálna rovnováha
Keď je systém uzavretý, rovnako ako pri reakciách vykonávaných v intermitentných reaktoroch (šaržový typ), masy jeho komponentov zvyčajne zaujímajú pred a po procese; to znamená, že medzi počiatočnými a poslednými T -krát t.
Preto sú množstvá vyjadrené ako obyčajné masy a nie rýchlosti. Tento typ rovnováhy sa mentálne vyrába, keď sa používa mixér: hmotnosť zložiek, ktoré vstupujú.
Príklad
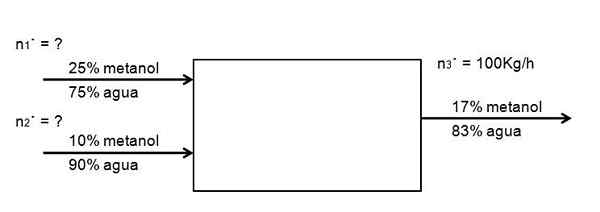
Je potrebné zriediť prietok 25% roztoku metanolu vo vode, s ďalšou z 10% koncentrácie, zriedenejšej, takým spôsobom, že 100 kg/h sa vytvára zo 17% roztoku metanolu. Koľko z oboch roztokov metanolu, na 25 a 10%, musí vstúpiť do systému za hodinu, aby sa to dosiahlo? Predpokladajme, že systém je v stacionárnom stave
Môže vám slúžiť: zubonifikáciaPríkaz je príkladom nasledujúceho diagramu:
 Prietokový diagram na riedenie riedenia roztoku metanolu. Zdroj: Gabriel Bolívar.
Prietokový diagram na riedenie riedenia roztoku metanolu. Zdroj: Gabriel Bolívar. Neexistuje žiadna chemická reakcia, takže množstvo metanolu, ktorý vstupuje, sa musí rovnať tomu, ktoré vyjde:
AMetanol = SMetanol
0,25 N1· + 0,10 N2· = 0,17 n3·
Je známa iba hodnota n3·. Zvyšok nie je známy. Na vyriešenie tejto rovnice dvoch neznámych je potrebná ďalšia rovnováha: rovnováha vody. Potom je rovnaká rovnováha pre vodu:
0,75 N1· + 0,90 N2· = 0,83 N3·
Hodnota n sa vyčistí pre vodu1· (Môže to byť tiež n2·):
n1· = (83 kg/h - 0,90n2·)/ (0,75)
Výmena potom n1· V rovnováhe záležitosti pre metanol a riešenie pre n2· Máš:
0,25 [(83 kg/h - 0,90n2·)/ (0,75)] + 0,10 n2· = 0,17 (100 kg/h)
n2· = 53,33 kg/h
A získať n1· Stačí odpočítať:
n1· = (100-53,33) kg/h
= 46,67 kg/h
Preto za hodinu musíte zadať 46,67 kg systém s roztokom 25%metanolu a 53,33 kg 10%roztoku.
Odkazy
- Felder a Rousseau. (2000). Základné princípy chemických procesov. (Druhé vydanie.). Addison Wesley.
- Fernández Germán. (20. októbra 2012). Definícia rovnováhy hmoty. Získaný z: priemyslu.slepo

