Apolárne molekuly
- 3853
- 263
- Alan Milota
Ten Apolárne molekuly Sú to tí, ktorí v ich štruktúre prítomné symetrické rozdelenie ich elektrónov. Je to možné, ak je rozdiel elektronickej farby jeho atómov malý alebo ak atómy alebo elektronegatívne skupiny zrušia svoje účinky na molekulu.
Nie vždy „apolarita“ je absolútna. Z tohto dôvodu sa zlé molekuly polarity považujú za apolar; to znamená, že má dipólový moment µ takmer 0. Tu zadáte relatívne pole: Ako nízko by malo byť µ tak, aby sa molekula alebo zlúčenina považovali za apolar?
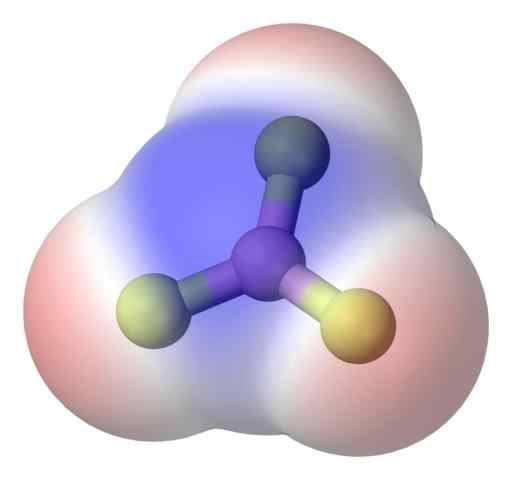
 Bf3 apolárna molekula. Zdroj: Benjah-Bmm27 Via Commons Wikimedia.
Bf3 apolárna molekula. Zdroj: Benjah-Bmm27 Via Commons Wikimedia. Ak chcete lepšie vyriešiť tento problém, máte molekulu Trifluorid bóru, bf3 (horný obrázok).
Atóm fluóru je omnoho viac elektronegatívny ako Boro's, a preto sú B-F odkazy polárne. Avšak molekula BF3 Je symetrická (trigonálna rovina) a znamená zrušenie vektora troch momentov B-F.
Generujú sa teda aj apolárne molekuly, a to aj s existenciou polárnych väzieb. Generovaná polarita môže byť vyvážená existenciou iného polárneho spojenia s rovnakou veľkosťou ako predchádzajúca, ale orientovaná v opačnom smere; Ako je to v bf3.
Charakteristiky apolárnej molekuly
Symetria
Aby sa účinky polárnych odkazov navzájom rušili, musí mať molekula špecifickú geometrickú štruktúru; Napríklad lineárne, najjednoduchšie porozumenie na prvý pohľad.
Toto je prípad oxidu uhličitého (CO2), ktorý má dve polárne odkazy (o = c = o). Je to preto, že dva dipólové momenty odkazov C = o sú zrušené, keď je jeden orientovaný na jednu stranu a druhý smerom k druhej, pod uhlom 180 °.
Môže vám slúžiť: TransamináciaPreto jednou z prvých charakteristík, ktoré sa majú zohľadniť, keď sa „apolarita“ molekuly vyhodnotí letom vtákov, je pozorovať, aké symetrické je.
Predpokladajme, že namiesto CO2 Máte molekulu cos (o = c = s), nazývaný karbonylsulfid.
Teraz už nie je apolárnou molekulou, pretože elektronegativita síry je menšia ako kyslík; A preto sa dipólový moment c = s líši od c = o. Výsledkom je, že COS je polárna molekula (polárna je múka iného vrecka).
Spodný obrázok graficky sumarizuje všetko novo opísané:
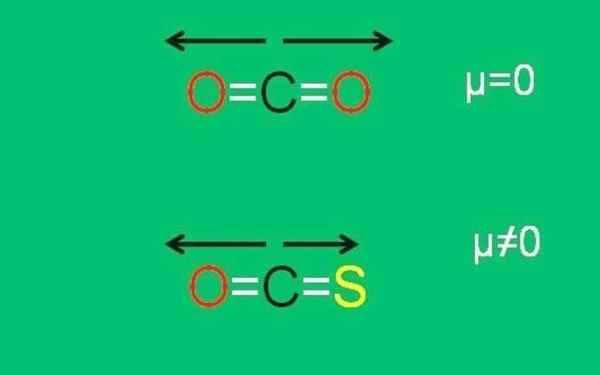 XXX Dipolárne momenty molekúl CO2 a COS. Zdroj: Gabriel Bolívar.
XXX Dipolárne momenty molekúl CO2 a COS. Zdroj: Gabriel Bolívar. Všimnite si, že moment dipólu odkazu C = S je menší ako odkaz C = o v molekule cos.
Elektronegativita
Elektronegativita na stupnici Pauling má hodnoty medzi 0,65 (pre Francio) a 4,0 (pre fluorid). Halogény majú vo všeobecnosti vysokú elektronegativitu.
Keď je rozdiel v elektronickejpativite prvkov, ktoré tvoria kovalentnú väzbu, menší ako 0,4, hovorí sa, že je apolárny alebo nie polárny. Jediné molekuly, ktoré sú skutočne apolárne, sú však tvorené väzbami medzi rovnakými atómami (ako je vodík, H-H).
Medzimolekulárne sily
Aby sa látka rozpustila vo vode, musí elektrostaticky interagovať s molekulami; interakcie, ktoré nemôžu vykonávať apolárne molekuly.
V apolárnych molekulách nie sú ich elektrické náboje obmedzené na jednom konci molekuly, ale symetricky distribuované (alebo homogénne). Preto nie je schopný interagovať prostredníctvom dipólových dipbolových síl.
Môže vám slúžiť: atómový objemNamiesto toho sa apolárne molekuly vzájomne pôsobia prostredníctvom londýnskych disperzných síl; Sú to okamžité dipóly, ktoré polarizujú elektronický oblak susedných molekúl atómov. Tu je molekulárna hmotnosť prevládajúcim faktorom vo fyzikálnych vlastnostiach týchto molekúl.
Ako identifikovať apolárne molekuly?
-Asi jednou z najlepších metód na identifikáciu apolárnej molekuly je jej rozpustnosť v rôznych polárnych rozpúšťadlách, ktoré sú v nich spravidla malé rozpustné.
-Všeobecne platí, že apolárne molekuly majú plynnú povahu. Môžu to byť tiež nemiešateľné tekutiny s vodou.
-Apolárne tuhé látky sa vyznačujú tým, že sú mäkké.
-Disperzné sily, ktoré ich držia pohromade, sú zvyčajne slabé. Z tohto.
-Apolárne molekuly, najmä v kvapalnej forme, sú zlými vodičmi elektriny, pretože im chýba čistý elektrický náboj.
Príklady apolárnych molekúl
Šľachetné plyny
Aj keď to nie sú molekuly, vznešené plyny sa považujú za apolar. Ak sa predpokladá, že dva z jeho atómov interagujú na krátku dobu, táto interakcia by sa mohla považovať za (polovicu) za molekulu; molekula, ktorá by bola apolárna povaha.
Diatomické molekuly
Diatomické molekuly, ako napríklad h2, Br2, i2, Cl2, o2, a f2, Sú apolar. Toto sú všeobecne2, A-a-a-a-a-.
Uhľovodík
Čo keby to bola skupina atómov? Bolo by to pred inými apolárnymi zlúčeninami; Napríklad etán, Cho3-Chvály3, ktorého uhlíková kostra je lineárna, C-C.
Metano, ch4, a etán, c2H6, Sú to apolárne molekuly. Uhlík má elektronegativitu 2,55; Zatiaľ čo vodíková elektronegativita je 2,2. Preto existuje dipólový vektor s nízkou intenzitou, orientovaný z vodíka na uhlík.
Môže vám slúžiť: Mohr Metóda: Základy, reakcie, postup, použitieAle v dôsledku geometrickej symetrie metánu a etánových molekúl je súčet dipólových vektorov alebo dipólových momentov v ich molekulách neplatný, takže v molekulách nie je žiadne čisté zaťaženie.
Všeobecne platí, že to isté sa deje so všetkými uhľovodíkami a aj keď v nich sú nenasýtení (dvojité a trojité väzby), považujú sa za apolárne alebo zlúčeniny s nízkou polaritou. Cyklické uhľovodíky sú tiež apolárne molekuly, ako je cyklohexan alebo cyklobután.
Ďalší
Molekuly oxidu uhličitého (CO2) a disulfid uhlíka (cs2) Sú to apolárne molekuly, obidve s lineárnou geometriou.
Pri disulfidu uhlíka je uhlíková elektronegativita 2,55, zatiaľ čo elektronegativita síry je 2,58; Takže oba prvky majú prakticky rovnakú elektronegativitu. Neexistuje generovanie dipólového vektora, a preto je čisté zaťaženie nulové.
K dispozícii sú aj nasledujúce molekuly CCL4 a ALBR3, obaja apolar:
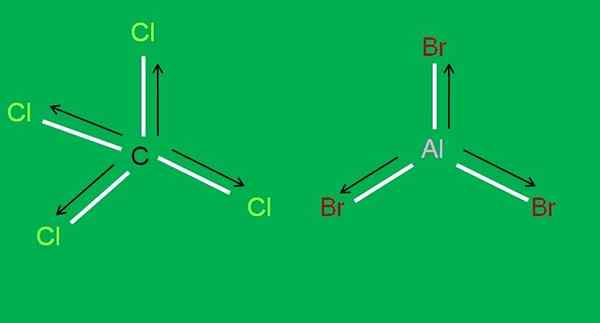 Molekuly CCL4 a ALBR3. Zdroj: Gabriel Bolívar.
Molekuly CCL4 a ALBR3. Zdroj: Gabriel Bolívar. V hliníkovom trbromide, Albb3 To isté sa stáva s BF3, Na začiatku článku. Medzitým pre uhlíkový tetrachlorid, CCL4, Geometria je tetraedrálna a symetrická, pretože všetky odkazy C-Cl sú rovnaké.
Podobne molekuly so všeobecným vzorcom CX4 (Porovnaj4, CI4 a CBR4) sú tiež apolar.
A nakoniec, apolárna molekula môže mať dokonca oktaedrálnu geometriu, ako je to v prípade hexafluoridu sulfur, sf6. V skutočnosti môžete mať akúkoľvek geometriu alebo štruktúru, pokiaľ je symetrická a jej elektronická distribúcia je homogénna.
Odkazy
- Nepolárna molekula. Získané z: chémie.Lektorka.com
- Príklad polárnych a nepolárnych molekúl. Zotavené z: Thoughtco.com
- « Rovnováha hmoty Čo je, všeobecná rovnica, typy
- Daniel Servitje Montull Biograph, Leadership and Costritions »

