Štruktúra anizolu, vlastnosti, nomenklatúra, riziká a použitie
- 3587
- 515
- Mgr. Pravoslav Mokroš
On anizol alebo metoxibenzén Je to organická zlúčenina, ktorá pozostáva z aromatického éteru, ktorého chemický vzorec je C6H5Okradnúť3. Jeho fyzická podmienka je stav bezfarebnej kvapaliny, ktorá môže prezentovať žlté sfarbenie. Ľahko sa rozpoznáva jeho charakteristickou vôňou anízu.
Potom je to prchavá zlúčenina a nie príliš vysoká súdržná sily; obvyklé vlastnosti v ľahkých éteroch, ktoré sú uložené v malých utesnených nádobách. Konkrétne, anizol je najjednoduchší alkyl Auril éter; to znamená, že tí, ktorí majú aromatickú zložku (AR) a ďalší alkyl (R), AR-O-R.
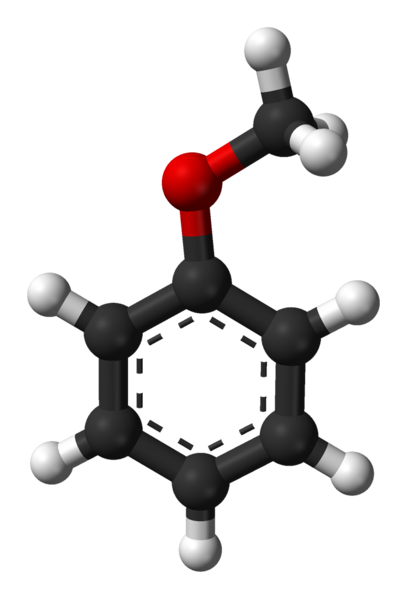
 Molekula anizolu. Zdroj: Ben Mills Via Wikipedia.
Molekula anizolu. Zdroj: Ben Mills Via Wikipedia. Skupina C6H5- Prichádza označovať AR a -ch3 R, tak má c6H5-Och3. Aromatický krúžok a prítomnosť -och3 Ako substituentná skupina nazývaná metoxi, anizol dáva nukleofilnosť lepšie ako benzén a nitrobenzén. Preto slúži ako sprostredkovateľská molekula pre syntézu zlúčenín s farmakologickou aktivitou.
Jeho charakteristická vôňa anízu sa používa na pridanie anizolu k kozmetickým a hygienickým výrobkom, ktoré vyžadujú príjemnú vôňu.
[TOC]
Anizolová štruktúra
Na hornom obrázku je molekulárna štruktúra anizolu znázornená pomocou modelu guľôčok a stĺpcov. Oceňuje sa aromatický prsteň, ktorého uhlíky sú SP2 a preto je plochý ako šesťuholníkový list; A súvisí s ním, je skupina Metoxi, ktorej uhlík je SP3, a jeho hydrogény sú nad alebo pod rovinou krúžku.
Dôležitosť skupiny -och3 V štruktúre ide nad rámec prelomenia s plochou geometriou molekuly: dáva mu polaritu, a preto benzénová apolárna molekula získava trvalý dipólový moment.
Dipolárny moment
Tento dipólový moment je spôsobený atómom kyslíka, ktorý priťahuje elektronickú hustotu aromatického aj metylového kruhu. Vďaka tomu môžu molekuly Anisolu interagovať po polovičných debolo silách; Aj keď mu chýba žiadna možnosť formovania vodíkových mostov, pretože ide o éter (ROR nemá prepojený kyslík).
Môže vám slúžiť: chlorid sodný (NaCl)Jeho vysoký bod varu (154 ° C), experimentálne certifikuje silné intermolekulárne interakcie, ktoré riadia jeho kvapalinu. Podobne sú prítomné londýnske disperzné sily, závislé od molekulárnej hmoty a interakcie π -π medzi samotnými krúžkami.
Kryštály
Štruktúra Anisolu mu však nedovolí.F = -37 ° C). Môže to byť tiež spôsobené skutočnosťou, že keď sú medzimolekulárne vzdialenosti znížené, elektrostatické odpory medzi susednými aromatickými kruhmi sú veľmi silné.
Preto a podľa kryštalografických štúdií nemôžu byť molekuly anizolu v kryštáloch pri teplote -173 ° C nariadené takým spôsobom, že ich krúžky čelia; to znamená, že jeho aromatické centrá sa navzájom nezhodujú, ale skupinová -och3 Je hore alebo pod susedným prsteňom.
Vlastnosti
Fyzický vzhľad
Bezfarebná tekutina, ale to môže predstavovať mierne vykladané slamené tóny.
Vôňa
Voní to mierne podobne ako semená anízu.
Príchuť
Sladké; Je však mierne toxický, takže tento test je nebezpečný.
Molekulárna hmotnosť
108 140 g/mol.
Hustota
0,995 g/ml.
Hustota
3,72 (vo vzdušnom vzťahu = 1).
Bod topenia
-37 ° C.
Bod varu
154 ° C.
zapaľovač
125 ° C (otvorený šálka).
Teplota
475 ° C.
Hrebeň
0,778 CP pri 30 ° C.
Povrchové napätie
34,15 DIN/cm A 30 ° C.
Lom indica
1 5179 až 20 ° C.
Rozpustnosť
Zle rozpustné vo vode (okolo 1 mg/ml). V iných rozpúšťadlách, ako je acetón, étery a alkoholy, je napriek tomu veľmi rozpustný.
Nukleofilita
Aromatický prsteň Anisolu je bohatý na elektróny. Je to preto, že kyslík, napriek tomu, že je veľmi elektronegatívnym atómom, prispieva s elektrónmi ich π mraku, aby ich demoizáciu cez kruh v mnohých rezonančných štruktúrach. V dôsledku toho viac elektrónov cestuje po aromatickom systéme, a preto zvyšuje jeho nukleofilnosť.
Môže vám slúžiť: Kampatý alkohol: štruktúra, receptúra, vlastnosti a použitiaExperimentálne bolo zvýšenie nukleofility demonštrované porovnaním jej reaktivity v tvár aromatickým elektrofylickým substitúciám s benzénom. Dôkazom je teda pozoruhodný účinok skupiny -och3 Na chemické vlastnosti zlúčeniny.
Malo by sa tiež poznamenať, že elektrofilné substitúcie sa vyskytujú v susedných pozíciách (-orto) a oproti (-for) so skupinou Metoxi; To znamená, že je to orto-pre riaditeľ.
Reaktivita
Aromatická nukleoophilita Anisolu už vám umožňuje nahliadnuť do toho, ako je jeho reaktivita. Substitúcie sa môžu vyskytnúť buď v kruhu (uprednostňované jeho nukleofilitou), alebo v tej istej skupine Metaxi; V druhom prípade je odkaz O-CH zlomený3 Na vymenenie -ch3 inou alquilalickou skupinou: O-alquilación.
Preto v alkylačnom procese môže anizol akceptovať skupinu R (fragment inej molekuly), ktorá nahradí H svojho prsteňa (život C) alebo nahradenie CH3 Z vašej skupiny Metoxi. Nasledujúci obrázok ilustruje, čo sa práve hovorí:
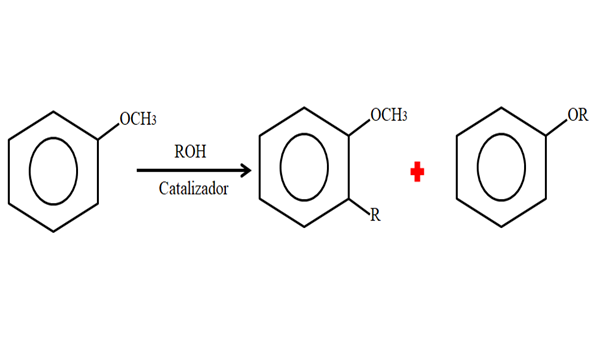 Alkylácia anizolu. Zdroj: Gabriel Bolívar.
Alkylácia anizolu. Zdroj: Gabriel Bolívar. Na obrázku je skupina R umiestnená v polohe -orto, ale môže byť tiež v polohe -for, oproti -och3. Keď sa stane O -alquilación, získa sa nový éter s inou skupinou -alebo sa získa.
Menovanie
Názov „anizol“ je najznámejší a akceptovaný, s najväčšou pravdepodobnosťou odvodeným z jeho zápachu podobnej anízu. Názov „metoxibenzén“ je však celkom špecifický, pretože sa stanovuje, keď je štruktúra a identita tohto aromatického éteru; Toto je názov riadený systematickou nomenklatúrou.
Ďalším menej použitým menom, ale rovnako platným, je „fenylmetyléter“, ktorý sa riadi tradičnou nomenklatúrou. Toto je možno najurčitejší názov zo všetkých, pretože priamo naznačuje, ktoré sú dve štrukturálne časti éteru: fenyl-o-metyl, c6H5-Och3.
Riziká
Lekárske štúdie zatiaľ nedokázali preukázať možné smrteľné účinky anizolu na telo pri nízkych dávkach. Avšak, rovnako ako takmer všetky chemické látky, vyvoláva podráždenie, keď je príliš čas vystavený času a v miernych koncentráciách pokožke, krku, pľúc a očí.
Môže vám slúžiť: Amagat zákon: Vysvetlenie, príklady, cvičeniaTiež z dôvodu nukleofility jeho kruhu, časť z nich je metabolizovaná, a preto je biologicky odbúrateľná. V skutočnosti v dôsledku tejto vlastnosti simulácie ukázali, že sa nezameriava na vodné ekosystémy, pretože jej organizmy ho najprv degradujú; A preto sa môžu akumulovať rieky, jazerá alebo moria.
V pôdach sa vzhľadom na svoju volatilitu rýchlo odparuje a je ťahaný vzduchovými prúdmi; Teda ani zeleninové masy ani plantáže významne neovplyvňujú.
Na druhej strane atmosféra reaguje s voľnými radikálmi, a preto nepredstavuje riziko znečistenia ovzdušia, ktoré dýchame.
Žiadosti
Organická syntéza
Z anizolu je možné získať ďalšie deriváty aromatickou elektrofilnou substitúciou. To umožňuje použitie ako sprostredkovateľ na syntézu liekov, pesticídov a rozpúšťadiel, ktoré sa chcú pridať svoje vlastnosti. Syntetické trasy môžu pozostávať z väčšiny.
Vône
Okrem použitia na organickú syntézu sa môže použiť priamo ako aditívka pre krémy, masti a parfumy, ktoré do týchto výrobkov začleňujú antirmy.
Odkazy
- Morrison, r. Tón. a Boyd, R, N. (1987). Organická chémia. 5. vydanie. Redakčný Addison-Wesley Inter-American.
- Carey F. Do. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. Amín. (10. vydanie.). Wiley Plus.
- Národné centrum pre biotechnologické informácie. (2019). Koleso. Databáza pubchem, CID = 7519. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Wikipedia. (2019). Koleso. Zdroj: In.Wikipedia.orgán
- Pereira, Cynthia C. M., De la Cruz, Marcus H. C., & Lachter, Elizabeth R. (2010). Kvapalná fálácia anizolu a fenol katalyzovaná fosfátom niobium. Journal of Brazílska chemická spoločnosť, 21 (2), 367-370. Dx.doi.org/10.1590/S0103-50532010000200025
- Seidel r. W. a Goddard R. (2015). Anizol pri 100 K: Prvé stanovenie štruktúry kryštálov. Crystallogr C Struct Chem Act. August; 71 (Pt 8): 664-6. Doi: 10.1107/S2053229615012553
- Chemická formulácia. (2018). Metoxibenzén. Získané z: Quimica Formulation.com

