Tréningová katión, rozdiely s aniónom a príkladmi

- 987
- 114
- JUDr. Rudolf Čapkovič
A katión Je to chemický druh, ktorý má pozitívny náboj. Dva typy existujúcich iónov sú pre anión. Jeho zaťaženie je produktom nedostatku elektrónov v atóme, čo spôsobuje, že základné protóny uplatňujú väčšiu príťažlivosť. Pre každý elektrón, ktorý stráca neutrálny atóm, sa v jednotke zvýši pozitívne zaťaženie.
Ak atóm stratí elektrón, a preto je počet protónov väčší ako jeden, jeho kladné zaťaženie bude +1; Ak stratíte dva elektróny, zaťaženie bude +2 atď. Ak má katión +1 zaťaženie, hovorí sa, že je monovalentný; Na druhej strane, ak je uvedené zaťaženie väčšie ako +1, hovorí sa, že katión je všestranný.
 Hydronio ión, jeden z najjednoduchších katiónov. Zdroj: Gabriel Bolívar.
Hydronio ión, jeden z najjednoduchších katiónov. Zdroj: Gabriel Bolívar. Na hornom obrázku je znázornené katión H3Ani+, nazývaný hydronio ión. Ako je vidieť, sotva má zaťaženie +1 v súlade s monovalentným katiónom.
Katióny sú dôležitými druhmi, pretože vyvíjajú elektrostatickú silu svojím prostredím a molekulami v okolí. Majú vysokú interakciu s vodou, kvapalina, ktorá ich hydratuje a prepravuje vo vlhkých pôdach, a potom dosiahnu korene rastlín a použijú sa na svoje fyziologické funkcie.
[TOC]
Ako sa vytvára katión?
Uviedlo sa, že keď atóm stratí elektrón, jeho najväčší počet protónov vo vzťahu k elektrónom vyvíja príťažlivú silu, ktorá sa premieta do kladného zaťaženia. Ale ako môže dôjsť k strate elektrónov? Odpoveď závisí od transformácie, ktorá sa vyskytla pri chemických reakciách.
Je potrebné poznamenať, že prítomnosť atómu s pozitívnym zaťažením nevyhnutne naznačuje tvorbu katiónu. Aby sa to mohlo považovať za také, nemalo by existovať atóm s negatívnym formálnym zaťažením, ktorý neutralizuje. Inak by došlo k príťažlivosti a odporu v rámci tej istej zlúčeniny a bolo by neutrálne.
Môže vám slúžiť: Síran vápenatý (Case4): Chemická štruktúra, vlastnosti, použitiaFormálne poplatky a ďalšie odkazy
Elektronegatívne atómy priťahujú elektróny svojich kovalentných väzieb k nim. Aj keď sa elektróny zdieľajú rovnako, existuje bod, v ktorom budú čiastočne mať menej elektrónov ako v bazálnej konfigurácii; To znamená, že ich voľné atómy bez toho, aby boli spojené s inými prvkami.
Potom tieto elektronegatívne atómy začnú zažívať nedostatok elektrónov a s ním protóny ich jadier budú mať silu väčšej príťažlivosti; Kladné formálne zaťaženie sa rodí. Ak existuje iba pozitívne formálne zaťaženie, zlúčenina prejaví globálne pozitívne iónové zaťaženie; Tak sa zrodila katión.
Atóm kyslíka katiónu h3Ani+ Je to verný príklad vyššie uvedeného. Tým, že má tri väzby O-H, jedna viac ako v molekule vody (H-O-H), zažíva stratu elektrónu vzhľadom na jeho bazálny stav. Výpočty formálnych zaťaženia umožňujú určiť, kedy k tomu dôjde.
Ak sa na jeden okamih predpokladá tvorba iného O-H, získa sa dvojročná katión4Ani2+. Všimnite si, že dvojročné zaťaženie v hornej časti katiónu je napísané nasledovne: Číslo nasledovalo symbol „+“; Rovnakým spôsobom sú anióny postupujúce.
Oxidácia
Kovy sú katiónové formátory par excellence. Nie každý však môže tvoriť kovalentné väzby (alebo aspoň čisto kovalentný). Namiesto toho strácajú elektróny, aby vytvorili iónové väzby: kladné zaťaženie priťahuje negatívny, zjednotený fyzickými silami.
Preto kovy strácajú elektróny, aby sa presunuli z M na Mn+, kde n Zvyčajne sa rovná počtu vašej skupiny v periodickej tabuľke; hoci n Môžete si vziať niekoľko celých hodnôt, ktoré sa vyskytujú najmä s prechodnými kovmi. Táto strata elektrónov sa vykonáva v type chemickej reakcie nazývanej oxidáciu.
Môže vám slúžiť: terciárny alkohol: štruktúra, vlastnosti, príkladyKovy oxidujú, strácajú elektrón, počet protónov ich atóm. Aby došlo k oxidácii, musí existovať oxidačné činidlo, ktoré znižuje alebo získava elektróny stratené kovmi. Kyslík je najznámejšie oxidačné činidlo zo všetkých.
Rozdiely s aniónom
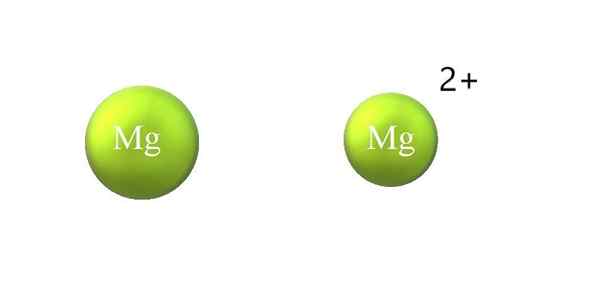 Kontrakcia atómového polomeru v katióne. Zdroj: Gabriel Bolívar.
Kontrakcia atómového polomeru v katióne. Zdroj: Gabriel Bolívar. Nižšie sú uvedené rozdiely medzi katiónom a aniónom:
-Všeobecná katión je menší ako anión. Horný obrázok ukazuje, ako sa atómový polomer MG zníži stratou dvoch elektrónov a stanete sa MG katiónom2+; Opak sa vyskytuje s aniónmi: stávajú sa objemnejšími.
-Má viac protónov ako elektróny, zatiaľ čo anión má viac elektrónov ako protónov.
-Hustota zaťaženia je menšia, je vyššia, a preto má väčšiu polarizačnú silu; to znamená, deformuje elektronické oblaky susedných atómov.
-Katión sa pohybuje rovnakým smerom ako v prípade aplikovaného elektrického poľa, zatiaľ čo anión tak robí v opačnom smere.
Príklady najbežnejších katiónov
Monoatomický
Monoatomické katióny pochádzajú väčšinou z kovov (s výnimkou určitých výnimiek, ako napríklad h+). Zvyšku je veľmi zriedkavé zvážiť katión odvodenú z nemetalického prvku.
Zistí sa, že mnohé z nich sú DI alebo všestranné a že veľkosti ich zaťaženia súhlasia s počtom ich skupín v periodickej tabuľke.
Môže vám slúžiť: Ribulosa-1,5-bifosfát (Rubp): Charakteristiky, karbolixácia-Li+
-Nat+
-Klimatizovať+
-Rb+
-Cs+
-Fr+
-Zápis+
Všetci majú spoločné zaťaženie „1+“, ktoré je napísané bez umiestnenia čísla a tiež pochádzajú zo skupiny 1: alkalické kovy. Okrem toho je tu katión AG+, Jeden z najbežnejších prechodných kovov.
-Byť2+
-Mg2+
-Ac2+
-Pán2+
-BA2+
-Rana2+
Tieto dvojmocné katióny odvodzujú z ich príslušných kovov patriacich do skupiny 2: alkaLinerior kovy.
-Do3+
-Utiecť3+
-V3+
-Tl3+
-NH3+
Trivalentné katióny skupiny Boro.
Doteraz boli príklady charakterizované tým, že majú jednu valenciu alebo načítanie. Iné katióny vykazujú viac ako jeden valenčný alebo pozitívny oxidačný stav:
-Sn2+
-Sn4+ (cín)
-Co2+
-Co3+ (kobalt)
-Au+
-Au3+ (zlato)
-Vernosť2+
-Vernosť3+ (železo)
A ďalšie kovy, ako napríklad mangán, môžu mať stále oveľa viac valencií:
-Mn2+
-Mn3+
-Mn4+
-Mn7+
Čím väčšie je zaťaženie, menšie a polarizácia bude katión.
Polyiatomický
Bez toho, aby sme chodili do organickej chémie, existujú anorganické a polylamické katióny, ktoré sú v každodennom živote veľmi bežné; ako:
-H3Ani+ (Hydronio, už spomínané).
-NH4+ (amónny).
-Nie2+ (Nitronio, prítomné v procesoch nitrácií).
-PH4+ (Fosfónium).
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- HelMestine, Anne Marie, PH.D. (5. mája 2019). Definícia a príklad katiónu. Zotavené z: Thoughtco.com
- Wyman Elizabeth. (2019). Katión: Definícia a príklad. Štúdium. Získané z: štúdie.com
- Figurín. (2019). Pozitívne a negatívne INS: Katióny a anióny. Získané z: figuríny.com
- Wikipedia. (2019). Katión. Obnovené z: je.Wikipedia.orgán
- « Štruktúra anizolu, vlastnosti, nomenklatúra, riziká a použitie
- Archeolitický pôvod, charakteristiky, podnebie, flóra a fauna »

