Štruktúra tepelnej alkoholu, vlastnosti, riziká a použitie
- 1736
- 409
- Adrián Fajnor
On Tepelný alkohol Je to organická zlúčenina, ktorej vzorec je (ch3)3COH alebo T-BUOH. Toto je najjednoduchší terciárny alkohol zo všetkých. V závislosti od okolitej teploty sa prezentuje ako pevná alebo tekutá bezfarebná. Na spodnom obrázku ukazujú napríklad ich bezfarebné kryštály.
Tento alkohol nie je substrátom pre enzým alkoholickú dehydrogenázu alebo pre peroxidázovú aktivitu katalázy, takže je klasifikovaný ako nemetabolizovateľný alkohol. Vďaka svojim biochemickým vlastnostiam sa predpokladá, že by mohla byť užitočná pri detekcii hydroxilov in vivo v intaktných bunkách.

Je to jeden zo štyroch izomérov izobutilického alkoholu, ktorý je menej náchylný izomér na oxidáciu a najmenej reaktívny. V prírode sa nachádza v cícer a v Cassava alebo Cassava, koreň, ktorý je fermentovaný na výrobu alkoholických nápojov.
Tepelný alkohol je veľmi rozpustný vo vode a organických rozpúšťadlách. Jeho hlavné použitie je ako rozpúšťadlo, ktoré túto úlohu plní pri vypracovaní plastov, parfumov, maľovacích reverzov atď.
Rovnako ako mnoho organických zlúčenín, je to trochu toxické, ale vo vysokých dávkach má narkotický efekt, ktorý sa vyznačuje bolesťami hlavy, vahidos, závraty, závraty a rozpad.
[TOC]
Štruktúra tepelného alkoholu
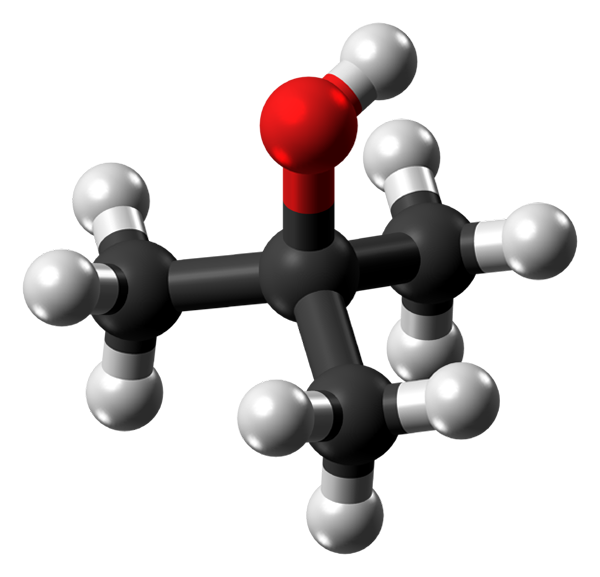
 Molekula tepelného alkoholu. Zdroj: Jynto cez Wikipedia.
Molekula tepelného alkoholu. Zdroj: Jynto cez Wikipedia. Na hornom obrázku máte molekulárnu štruktúru tepelného alkoholu s modelom guľôčok a tyčí. Celá molekula má globálnu tetraedrálnu geometriu, pričom v jej strede sa nachádza 3. uhlík a skupiny3 a oh vo svojich vrcholoch.
Pri pozorovaní tejto štruktúry sa chápe, prečo je tento alkohol terciárny: uhlík v centre je spojený s tromi ďalšími uhlíkmi. Pokračovanie s tetraedronom, jeho spodná časť sa môže považovať za apolar, zatiaľ čo jeho horný vrchol, polárny.
Môže vám slúžiť: Fehlingova reakcia: prípravy, aktívne agenti, príklady, použitiaV tomto vrchole je skupina OH, ktorá vytvára trvalý dipól a tiež umožňuje molekúl T-BuOH interagovať cez vodíkové mosty; rovnako ako s molekulami vody a inými polárnymi látkami.
V kryštáloch T-Buah sú tieto vodíkové mosty kľúčovým faktorom, aby molekuly zostali spolu; Aj keď nie je príliš veľa informácií o tom, aká je kryštalická štruktúra tohto alkoholu.
Keď je skupina OH tak blízko a obklopená apolárnymi skupinami Cho3, Molekuly vody dokážu hydratovať takmer všetok alkohol pri interakcii s OH. To by vysvetlilo jeho veľkú rozpustnosť vo vode.
Vlastnosti
Chemické názvy
-Tepelný alkohol
-Trik
-2- metyl-2-propanol
-2-metylpropan-2-ol.
Molekulárna receptúra
C4H10O (Cho3)3CoH.
Molekulová hmotnosť
74,123 g/mol.
Fyzický popis
Bezfarebná tuhá alebo bezfarebná kvapalina, v závislosti od teploty okolitého okolia, pretože bod topenia je 77,9 ° F (25,4 ° C). Nad 77,9 ° F je kvapalina.
Vôňa
Podobne ako v gáfor.
Bod varu
82,4 ° C.
Bod topenia
77,9 ° F (25,4 ° C).
zapaľovač
52 ° F (11 ° C). Zatvorený pohár.
Rozpustnosť
Veľmi rozpustný. V skutočnosti, bez ohľadu na rozmery, tento alkohol je vždy miešateľný s vodou.
Rozpustnosť v organických rozpúšťadlách
Misilné s etanolom, etyléterom a rozpustným v chloroforme.
Hustota
0,78 g/cm3.
Hustota pary
2,55 (s vzťahom vzduchu = 1).
Tlak vodnej pary
4,1 kPa pri 20 ° C.
Koeficient priečneho októbra/vody
Log p = 0,35.
Termostabilita
Nestabilný v horúčave
Samostatná teplota
896 ° F (470 ° C).
Môže vám slúžiť: alikvot (chémia)Rozklad
Pri zahrievaní môže uvoľňovať výpary oxidu uhličitého a izobutilénu.
Odparovanie
39,07 kj/mol.
Kaliforka
215,37 JK-1mol-1.
Výcvik
-360.04 až -358,36 kjmol-1.
Úložisko
2-8 ° C.
Stabilita
Je stabilný, ale nekompatibilný so silnými oxidačnými činidlami, meďou, zliatinami medi, alkalickými a hliníkovými kovmi.
Ionizačný potenciál
9,70 eV.
Prah
219 mg/m3 (nízka vôňa).
Index lomu
1 382 až 25 ° C.
Disociačná konštanta
Pka = 19,20.
Maximálna koncentrácia pary
5,53 % pri 25 ° C.
Reakcie
-Je to nepríjemné silnou základňou, ktorá spôsobí alkoxidový anión; Konkrétne terbutoxid (ch3)3Co-.
-Tepelný alkohol reaguje s chloridom vodíka za vzniku terbutylchloridu.
(Ch3)3COH +HCI => (ch3)3CCL +H2Ani
Terciárne alkoholy majú väčšiu reaktivitu s hydrogénovými halogenidmi ako sekundárne a primárne alkoholy.
Riziká
Tepelný alkohol kontaktom s pokožkou produkuje mierne lézie, ako je erytém a non -náročná hyperémia. Okrem toho neprechádza pokožkou. Naopak, v očiach vyvoláva vážne podráždenie.
Keď je vdýchnutá, vytvára podráždenie v nose, krku a bronchi. V prípade vysokej expozície, narkotické účinky, stav ospalosti, ako aj bledne, môžu sa vyskytnúť vhidos a bolesti hlavy.
Tento alkohol je experimentálne teratogénne činidlo, takže bolo pozorované u zvierat, ktoré môžu ovplyvniť výskyt vrodených porúch.
Pokiaľ ide o jeho skladovanie, jeho tekutina a výpary sú horľavé, a preto za určitých okolností môže generovať požiare a výbuchy.
OSHA stanovila koncentračný limit 100 ppm (300 mg/m3) Na 8 -hodinový deň.
Môže vám slúžiť: Percentuálne riešeniaŽiadosti
-Termálny alkohol sa používa na začlenenie tepelnej skupiny do organických zlúčenín, aby sa pripravili rozpustné oleje v olejoch a trinitro-tter-buletoluén, umelý pižmo. Okrem toho predstavuje počiatočný materiál na prípravu peroxidov.
-FDA ho schválila ako splifingové činidlo, ktoré sa používa v komponentoch a plastových materiáloch, ktoré sú v kontakte s potravinami. Používa sa na vypracovanie ovocia, plastov a esencií Lacas.
-Je sprostredkovateľom na výrobu terbutyl a chlorid trivitilfenol. Pôsobí ako denaturingový agent etanolu.
-Podávame na výrobu flotačných činidiel ako organické rozpúšťadlo na odstránenie obrazov a na rozpustenie esencií používaných v parfémoch.
-Používa sa ako oktánový zosilňovač v benzíne; palivové a palivové prísady; Rozpúšťadlo, ktoré sa má použiť pri čistení a ako nešťastný.
-Tepelný alkohol je sprostredkovateľom pri výrobe terbutylmetyléteru (MTBE) a tributetyléter (ETBE), reaguje s metanolom a etanolom a etanolom.
-Pôsobí tiež rovnakým spôsobom pri výrobe tributyl hydroperoxidu (TBHP) reakciou s peroxidom vodíka.
-Používa sa ako činidlo v procese známeho ako Curtius chrbát.
Odkazy
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. Amín. (10th Vydanie.). Wiley Plus.
- Wikipedia. (2019). Terc-butylalkohol. Zdroj: In.Wikipedia.orgán
- Spoločná kocka. (s.F.). T-butanol. Získané z: Commonorganicchemistry.com
- Národné centrum pre biotechnologické informácie. (2019). Trik butanol. Databáza pubchem. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Carey F. Do. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- « Charakteristiky a príklady postoja
- Čo by sa mali deti a mladí ľudia z 21. storočia naučiť konať v dnešnom svete? »

