Štruktúra acetylcholínesterázy, funkcie a inhibítory
- 3497
- 1070
- Alfréd Blaho
Ten acetylcholínesteráza (Acetylcholín acetylsa hydrolese, EC 3.1.1.7) Je to enzým, ktorý je hlavne v centrálnom nervovom systéme. Jeho úlohou, ako už názov napovedá, je hydrolytické spracovanie neurotransmitera acetylcholínu.
Je to enzým spojený s bunkovou membránou, ktorý spolupracuje s acetylcholínovým prijímačom na sprostredkovaní excitácie postsynaptických buniek a ktorých katalytický mechanizmus je prekvapivo rýchly.
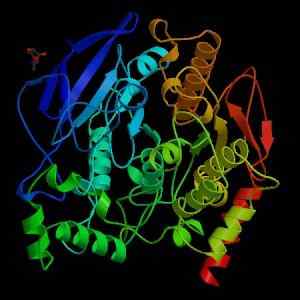
 Štruktúra acetylcholinesterázy (zdroj: Wikimedia Commons)
Štruktúra acetylcholinesterázy (zdroj: Wikimedia Commons) Z mechanického hľadiska sa tento enzým môže vnímať ako serin-hydroláza av katalytickej doméne jeho aktívneho miesta obsahuje trojicu aminokyselín charakteristických pre proteázy: serín, histidín a kyslý zvyšok. Kyslý zvyšok je však glutamát, zatiaľ čo proteázy majú normálne aspartát.
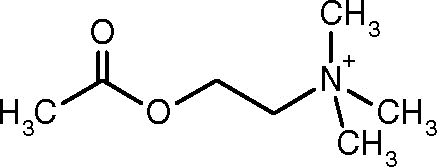 Štruktúra acetylcholínu (zdroj: alinebloom [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons)
Štruktúra acetylcholínu (zdroj: alinebloom [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons) Jedným z prvých pozorovaní, ktoré spájali katalytickú aktivitu acetylcholinesterázy s cholinergnými nervovými tkanivami a svalovými tkanivami, bola aktivita vyrobená spoločnosťou Dale v roku 1914; Následne sa zistilo, že je prítomný aj v neurónoch a v hematopoetických, osteogénnych a neoplastických bunkách.
Vďaka štúdiu rôznych organizmov je v súčasnosti známe, že enzým je prítomný v membráne rôznych typov buniek, ako sú erytrocyty, nervové a svalové bunky, elektrické orgány a ďalšie.
[TOC]
Štruktúra
Terciárna a kvartérna štruktúra
V prírodných podmienkach alebo “in vivo ", Acetylcholinesteráza je polymorfný enzým, ktorý pozostáva z niekoľkých katalytických podjednotiek s viac alebo menej 80 kDa, ktoré sú zostavené tak, aby tvorili oligomérnu štruktúru (z niekoľkých podjednotiek).
Množstvo a zložitosť týchto podjednotiek závisí od typu bunky a druhov, ktoré sa považujú.
Niektoré z najkomplexnejších enzymatických foriem majú katalytické podjednotky s globulárnymi formami (G) alebo asymetrickými (A) spojenými s disulfidovými mostmi. Disulfidové mostíky sú kovalentné väzby vytvorené medzi dvoma molekulami síry v skupinách Tiol (-SH) dvoch zvyškov kyseliny cysteínovej kódov.
Každé podjednotky G obsahuje jediné aktívne miesto, zatiaľ čo podjednotky A sa zvyčajne vyznačujú prezentovaním troch štrukturálnych domén, konkrétne: katalytické podjednotky, kolagénové chvosty bohaté na glycín, hydroxiprolín a odpad z hydroxilisínu a ďalšie nekolagénne chvosty (odlišné od kolagénu).
Asymetrické formy acetylcholinesterázy sú známe ako A12, A8 a A4, ktoré majú katalytické podjednotky 12, 8 a 4.
Môže vám slúžiť: Flora a fauna z Afriky: Reprezentatívne druhyVšeobecne platí, že zvyšky katalytickej domény v aktívnom mieste sú v „hlbokej“ oblasti podjednotiek, ktoré by sa dali považovať za protichodné, pokiaľ ide o rýchlu rýchlosť reakcie, ktorá katalyzuje tento enzým a zjavnú neprístupnosť substrátu do substrátu do tieto stránky.
Bez ohľadu na enzýmový polymorfizmus má guľometové aj asymetrické podjednotky podobné katalytické aktivity.
Varianty
Niektoré bunky iné ako nervové bunky, pretože erytrocyty produkujú prevažne globulárne, dimetrické a väčšinou asociované acetylcholínske enzýmy s vonkajšou tvárou plazmatickej membrány.
Enzým erytrocytov, hoci menej štrukturálnej zložitosti, je tiež amfipatický enzým, ktorého aktívna katalytická doména sa nachádza vo veľkej hydrofilnej oblasti, zatiaľ čo hydrofóbna doména, ktorá obsahuje terminálnu karboxylovú oblasť, je zodpovedná za jej udržanie v membráne.
Primárna štruktúra
Väčšina súčasných vedomostí o sekvencii acetylcholinesterázy vznikla zo štúdie enzýmu Torpédo kalifornice, Rybia rýb, ktorá žije v Tichom oceáne a ktorá sa tradične používa ako modelový organizmus na štúdium rôznych bielkovín nervového systému.
Podjednotky acetylcholinesterázy sú syntetizované ako pro-proteíny, ktoré sa potom spracujú tak, aby vznikli zrelé podjednotky. Každá podjednotka pozostáva z polypeptidu asi 575 aminokyselín a molekulovej hmotnosti 65 kDa, čo sa zvyšuje pridaním 7-8% uhľohydrátového odpadu (glykozylácia).
Katalytická aktivita aktívneho miesta podjednotiek je určená serínovým zvyškom v polohe 200, ktorá je v „hlbokej“ oblasti katalytických podjednotiek.
Rôzne varianty alebo izoformy enzýmu existujú v organizmoch vďaka rôznym miestam pre “alternatívne zostrih “ z predpremenných poslov na oboch ich koncoch (5 'a 3'). Karboxylovo terminálna sekvencia izoformy každej podjednotky je tá, ktorá určuje zostavu oligomérov navzájom.
Funkcia
Acetylcholinesteráza je enzým s viacerými biologickými funkciami, ktoré navzájom nevyhnutne súvisia. Potvrdené jeho diferenciálnou expresiou počas embryogenézy, embryonálne nervové rozšírenie, vývoj svalov a synptogenéza.
Ako už bolo zdôraznené, má dôležitú funkciu v rýchlej hydrolýze acetylcholínu, a preto v regulácii jeho účinku na neuromuskulárny synaptický priestor alebo v spoločných synaptických priestoroch centrálneho nervového systému centrálneho nervového systému.
Môže vám slúžiť: Aplikácie biológie v hospodárskych zvieratáchPríkladom jeho funkcií je kontrakcia kostrového svalu, ktorá sa vyskytuje vďaka typu chemickej synapsií známeho ako motorický plak, ktorý sa nachádza medzi motorickým neurónom a svalovou vláknou.
V tejto synapse sa dosahuje stovky vezikúl naložených acetylcholínom, ktoré sa uvoľňujú z motorického neurónu na šírenie elektrického impulzu.
Tento proces neurotransmisie je dosť zložitý, ale účasť acetylcholinesterázy je rozhodujúca pre ukončenie synaptického prenosu, ktorý závisí od acetylcholínového neurotransmiteru, pretože musí byť degradovaný a potom sa šíriť mimo synaptickej sŕčeb.
Enzým acetylcholinesterázy je teda zodpovedný za reguláciu koncentrácie tohto vysielača v synapse Neuromotora.
Iné „neklasické“ funkcie enzýmu súvisia s neuritogenézou alebo rastom nervových buniek; S procesmi adhézie bunkovej adhézie, synaptogenézou, aktiváciou neurónov-dopamínu v čiernej látke stredného mozgu, hematopoetickými procesmi a trombusovou poetickou.
Inhibítory
Inhibítory acetylcholinesterázy fungujú, ktoré sa hydrolyzujú na acetylcholíny, čím sa zvyšuje hladina a trvanie pôsobenia tohto neurotransmitera. Môžu byť klasifikované podľa svojho mechanizmu pôsobenia ako reverzibilné a nezvratné.
Nezvratné inhibítory
Sú to tie, ktoré ireverzibilne inhibujú hydrolytickú aktivitu acetylcholinesterázy v dôsledku ich kovalentného spojenia serínového zvyšku v aktívnom mieste enzýmu. Táto skupina sa skladá hlavne z organofosfátu.
Vo všeobecnosti ide o aktívne zlúčeniny prítomné v mnohých insekticídoch a sú zodpovedné za veľké množstvo náhodných úmrtí v dôsledku otravy. Sú to estery alebo tioly odvodené z kyseliny fosforečniny, fosfózie, fosfínu alebo fosforamídico kyseliny.
Sarin, Tabun, Soman a cyklosarín patria medzi najtoxickejšie zlúčeniny syntetizované človekom, pretože môžu zabiť človeka indukciou respiračných a obehových porúch v dôsledku blokády acetylcholinesterázy v periférnom nervovom systéme.
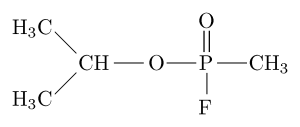 Molekulárna štruktúra organofosfátového inhibítora „Sarín“ (zdroj: Sivizius [verejná doména] prostredníctvom Wikimedia Commons)
Molekulárna štruktúra organofosfátového inhibítora „Sarín“ (zdroj: Sivizius [verejná doména] prostredníctvom Wikimedia Commons) Napríklad Sarin je „nervový plyn“, ktorý sa používa ako chemická zbraň na teroristické použitie.
Reverzibilné inhibítory
Toto poradie klasifikačných skupín konkurencieschopné a nekonkurenčné inhibítory, ktoré pracujú prostredníctvom prechodnej a reverzibilnej karbamylácie serínového zvyšku na aktívnom mieste a mnohé z nich boli syntetizované a čistené z rastlinných alebo hubových zdrojov.
Môže vám slúžiť: Sokes: Charakteristiky, štruktúra, funkcieKarbamáty, ako je fyzostigmín a neostigmín, sú reverzibilné inhibítory, ktoré sa používajú ako lieky na liečbu chorôb, ako je glaukóm a miasténia gravis.
Na liečbu Alzheimerovej choroby, Parkinsonovho Parkinsona, pooperačných črevných obštrukcií (pooperačné ileus), distenzia močového mechúra a ako antidoty na predávku s anticholinergiou sa používajú aj ďalšie terapeutické činidlá tejto skupiny.
Butirilkolinesteráza
Zaujímavý prírodný mechanizmus proti niektorým inhibičným látkam acetylcholinesterázy súvisí s účasťou menej špecifického enzýmu známeho ako butirilcolinesteráza.
Tento enzým je tiež schopný hydrolyzovať.
Acetylcholinesteráza a Alzheimerova choroba
Ukázalo sa, že acetylcholinesteráza tvorí stabilný komplex so zložkami Senilesov charakteristiky patológie. Okrem toho niektoré zmenené vzorce glykozylácie tohto enzýmu súviseli s prítomnosťou a tvorbou amyloidných plakov v mozgu.
Mnohé z reverzibilných inhibítorov acetylcholinesterázy sa preto používajú ako lieky prvej generácie na liečbu tohto ochorenia a ďalších súvisiacich neurodegeneratívnych stavov. Medzi nimi patrí Donepezilo, Rivastigmina a galantamín.
Odkazy
- Dvir, h., Silman, i., Harel, m., Rosenberry, T. L., & Sussman, J. L. (2010). Acetylcholinesteráza: od 3D štruktúry po funkciu. Chemické biologické interakcie, 187, 10-22.
- Houghton, P., Ren, a., & Howes, M. (2006). Inhibítory acetylcholinesterázy z rastlín a húb. Správy o prírodných produktoch, 23, 181-199.
- Krsti, D. Z., Lazarevi, T. D., Puto a. M., & Vasi, V. M. (2013). Inhibítory acetylcholinesterázy: farmakológia a toxikológia. Súčasná neurofária, jedenásť, 315-335.
- Mukherjee, P. Klimatizovať., Kumar, v., Zlé, m., & Houchton, P. J. (2007). Inhibítory acetylcholinesterázy z rastlín. Fytomedicín, 14, 289-300.
- Quinn, D. M. (1987). Acetylcholinesteráza: štruktúra enzýmov, dynamika reakcie a stavy virtuálneho prechodu. Chem. Otáčať sa., 87, 955-979.
- Racchi, m., Mazzucchelli, m., Porrello, e., Lanni, C., & Govoni, s. (2004). Inhibítory acetylcholinesterázy: Nové aktivity starých molekelov. Farmakologický výskum, päťdesiat, 441-451.
- Rosenberry, T. (1975). Acetylcholínesteráza. Pokrok v enzymológii a súvisiacich oblastiach molekulárnej biológie, 43, 103-218.
- Soreq, h., & Seidman, s. (2001). Acetylcholinesteráza - nové úlohy pre starého herca. Recenzie prírody, 2, 294-302.
- Tales, V. N. (2001). Acetylcholinesteráza pri Alzheimerovej chorobe. Mechanizmy starnutia a rozvoja, 122, 1961-1969.

