Draselný yodato (Kio3)
- 899
- 114
- MUDr. Žigmund Boška
Čo je jodát draselný?
Draslík alebo draselný yodato yodato je anorganická jódová zlúčenina, konkrétne soľ, ktorej chemický vzorec je kio3. Jód alebo jód, prvok halogénovej skupiny (F, Cl, Br, I, AS), má v tejto soli oxidačné číslo +5; Preto je to silné oxidačné činidlo. Kio3 Disociuje sa vo vodnom médiu, aby vytvorila ióny K+ a io3-.
Je syntetizovaný reagovaním hydroxidu draselného s kyselinou yodium: hio3(aq) + koh (s) => kio3(aq) + h2Alebo (l). Tiež sa dá syntetizovať reakciou molekulárneho jódu s hydroxidom draselným: 3i2(s)+6koh (s) => kio3(aq) + 5 ki (aq) + 3h2Alebo (l).
Vlastnosti draselného yodato
 Vzhľad draslíka yodato
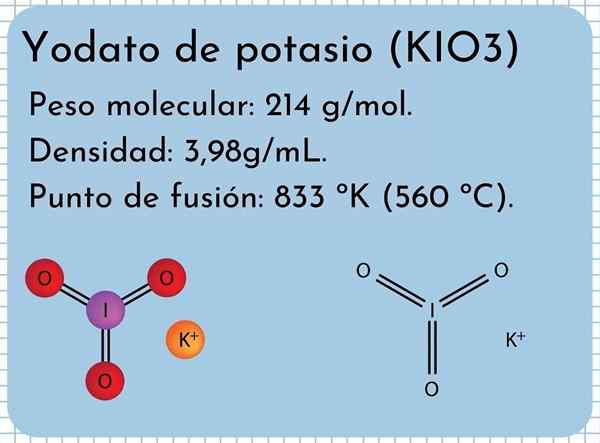
Vzhľad draslíka yodato Je to bez zápachu biela, jemná kryštály a monoklinická kryštalická štruktúra. Má hustotu 3,98 g/ml, molekulovú hmotnosť 214 g/mol a predstavuje absorpčné pásy v infračervenom spektre (IR).
Má bod topenia: 833 ° K (560 ° C), pozostávajúci zo silných iónových interakcií medzi K iónmi+ a io3-. Pri vyšších teplotách, reakcia tepelnej rozkladu, uvoľňujúce molekulárny kyslík a jodid draselný:
2 kio3(s) => 2 ki (s) + 3o2g)
Vo vode má rozpustnosti, ktoré sa pohybujú od 4,74 g/100 ml do 0 ° C, až do 32,3 g/100 ml pri 100 ° C, čo vytvára bezfarebné vodné roztoky. Okrem toho je nerozpustný v kyseline alkoholu a dusičnej, ale je rozpustný v zriedenej kyseline sírovej.
Jeho afinita k vode nie je značná, čo vysvetľuje, prečo nie je hygroskopický a neexistuje vo forme hydratovaných solí (Kio3· H2Buď).
Oxidačný činiteľ
Draselný yodato, ako je naznačené jeho chemickým vzorcom, má tri atómy kyslíka. Toto je silne elektronegatívny prvok a vďaka tejto vlastnosti ponecháva „objavený“ nedostatok elektronického oblaku, ktorý obklopuje jód.
Môže vám slúžiť: inertné plynyTento nedostatok - alebo príspevok, ako je to možné, môže byť vypočítaný ako oxidačné číslo jódu (± 1, +2, +3, +5, +7), čo je v prípade tejto soli +5.
Čo to znamená? Že pred druhom schopným dať ich elektróny ich jód prijme v ich iónovej podobe (io3-) stať sa molekulárnym jódom a mať oxidačné číslo rovné 0.
Po tomto vysvetlení je možné zistiť, že jodát draselného je oxidačná zlúčenina, ktorá intenzívne reaguje s redukčnými činidlami v mnohých redoxných reakciách; Z toho všetkého je jeden známy ako jódové hodiny.
Jódové hodiny pozostávajú z redoxného procesu pomalých a rýchlych krokov, v ktorom sú rýchle kroky označené roztokom Kio3 V kyseline sírovej, ku ktorej sa pridá škrob. Potom, škrob -once vyrobený a ukotvený medzi jeho štruktúrou, druh i3-- Z toho urobí farebné modré roztok do tmavo modrej farby.
Io3- + 3 HSO3- → i- + 3 HSO4-
Io3- + 5 i- + 6 h+ → 3 i2 + 3 h2Ani
Jo2 + HSO3- + H2O → 2 i- + HSO4- + 2 h+ (tmavo modrá kvôli škrobu)
Chemická štruktúra
 Štruktúra draslíka Yodato
Štruktúra draslíka Yodato Na vynikajúcom obraze je ilustrovaná chemická štruktúra jodátu draselného. Io anión3- Je zastúpený „statív“ červených a fialových guľôčok, zatiaľ čo K ióny+ Sú zastúpené fialovými guľami.
Čo však tieto statívy znamenajú? Správne geometrické tvary týchto aniónov sú v skutočnosti trigonálne pyramídy, v ktorých kyslík tvorí trojuholníkovú základňu a nezdieľaný krútiaci moment jódu smeruje na poschodie, zaberá priestor a núti sklopiť spojenie I-O a dva odkazy I = o.
Môže vám slúžiť: kyselina z tartarovejTáto molekulárna geometria zodpovedá hybridizácii SP3 centrálneho atómu jódu; Ďalšia perspektíva však naznačuje, že jeden z atómov kyslíka sa vytvára odkazy na orbitály „d“ jódu, v skutočnosti je hybridizáciou typu SP3d2 (jód môže mať svoje „d“ orbitály rozširujúce svoju vrstvu Valencie).
Kryštály tejto soli môžu v dôsledku rôznych fyzikálnych podmienok, ktoré ich podrobujú, trpia štrukturálnymi fázovými prechodmi (iné usporiadania iné ako monoklinické).
Použitie a aplikácie jodátu draselného
Terapeutické použitie
Draselný yodato sa zvyčajne používa na zabránenie akumulácii rádioaktivity v štítnej žľaze vo forme 131I, keď sa tento izotop používa pri určovaní jódu štítnou žľazou ako súčasť operácie štítnej žľazy.
Podobne sa v slizniciach používa ako lokálny antiseptikum (0,5 %) v slizniciach.
Použitie v priemysle
Pridáva sa k jedlu chovných zvierat ako doplnku jódu. Preto sa v priemysle používa draselný yodato na zlepšenie kvality múky.
Analytické použitie
V analytickej chémii sa vďaka svojej stabilite používa ako primárny vzorec pri štandardizácii vzorov tiosíranu sodného (NA2Siež2Ani3) s cieľom určiť koncentrácie jódu v problémoch s problémami.
To znamená, že množstvá jódu môžu byť známe objemovými technikami (stupne). V tejto reakcii sa jodát draselný rýchlo oxiduje na jodidové ióny i-, Prostredníctvom nasledujúcej chemickej rovnice:
Môže vám slúžiť: octanu olovo: štruktúra, vlastnosti, získanie, použitieIo3- + 5i- + 6H+ => 3i2 + 3h2Ani
Jód, i2, je názov s roztokom NA2Siež2Ani3 pre svoju štandardizáciu.
Používanie v laserovej technológii
Štúdie preukázali a potvrdili zaujímavé piezoelektrické, pyroelektrické, elektrooptické, ferroelektrické a nelineárne optické vlastnosti kryštálov Kio3. To má za následok veľký potenciál v elektronickom poli a technológiu laserov pre materiály vyrobené z tejto zlúčeniny.
Zdravotné riziká draselného yodátu
Vo vysokých dávkach môže produkovať podráždenie v ústnej sliznici, koži, očiach a dýchacích cestách.
Experimenty toxicity jodátu draselného u zvierat nám umožnili pozorovať, že u psov rýchlo, v dávkach 0,2-0,25 g/kg telesnej hmotnosti, dodávané perorálne, zlúčenina spôsobuje zvracanie.
Ak sa tomuto zvracaniu vyhýba, vyvoláva u zvierat zhoršenie svojej situácie, pretože sa vyvoláva anorexia a pred smrťou pred smrťou. Jeho pitvy umožnili pozorovať nekrotické lézie pečene, obličky a črevnú sliznicu.
Vďaka svojej oxidačnej sile predstavuje riziko požiaru, keď príde do kontaktu s horľavými materiálmi.
Odkazy
- Deň, r., & Underwood, a. Kvantitatívna analytická chémia (Piate ED.). Pearson Prentice Hall, P-364.
- Chemická kniha. (2017). Draselný jodát. Získané 25. marca 2018 z Chemicalbook: Chemicalbook.com
- Publikácia. (2018). Draselný jodát. Získané 25. marca 2018 z Pubchem: Pubchem.Ncbi.NLM.NIH.Vláda
- Milosť. (2018). Draselný yodato. Získané 25. marca 2018 od spoločnosti Merck:
- Merckmillipore.com
- M M Abdel Kader a kol. (2013). Mechanizmus prenosu náboja a fázové prechody nízkej teploty v Kio3. J. Fyzický.: Conf. Byť. 423 012036

