Základné oxidy

- 4218
- 1242
- Denis Škriniar
Vysvetľujeme, aké sú základné oxidy, ako sa tvoria ich vlastnosti, nomenklatúra a uvádzajú niekoľko príkladov,
 Mnoho základných oxidov má výrazné, charakteristické pre kovové farby
Mnoho základných oxidov má výrazné, charakteristické pre kovové farby Čo sú základné oxidy?
Ten základné oxidy Sú to anorganické zlúčeniny, ktoré tvoria spojenie medzi kyslíkom a kovom. Nazývajú sa základné oxidy, pretože pri rozpúšťaní vo vode vyrábajú alkalické alebo základné roztoky. Tiež preto, že reagujú s kyselinami za vzniku soli a vody prostredníctvom neutralizačnej reakcie kyslou bázou.
Základné oxidy sú veľmi bežné. V skutočnosti sa väčšina kovov v prírode nachádza v oxidových pôdach, takže sa nazývali krajina.
Základné oxidy majú pre priemysel veľký význam. Mnoho farebných pigmentov používaných v priemysle sú oxidy. Ostatné oxidy sa používajú ako základ pre maľby, najmä pre titány, olova a oxidy zinočnatého.
Vlastnosti základných oxidov
Sú to binárne zlúčeniny
Tieto zlúčeniny sú tvorené iba dvoma prvkami: kyslík a kov. Preto ide o binárne zlúčeniny.
Jeho empirický vzorec je m2AniX alebo moX/2
Valencia kyslíka v oxidoch je vždy -2, takže empirické vzorce oxidov sa zjednodušia, keď je kovová valencia číslo krútiaceho momentu. To isté sa však nestane, keď je to čudné.
Napríklad empirický vzorec oxidu sodného je NA2Alebo pretože sodík má Valencia +1 (nepárne). Namiesto toho je empirický vzorec oxidu vápenatého CAO, pretože vápnik má Valencia +2.
Sú to anorganické zlúčeniny, takmer vždy iónové
Väčšina základných oxidov sú kryštalické iónové zlúčeniny. To zahŕňa oxidy všetkých alkalických kovov, všetkých alkalinerov (s výnimkou berylia) a prvej série prechodných kovov.
Môže vám slúžiť: Chemická väzbaMajú veľmi vysoké body fúzie a varu
Iónová väzba udržuje všetky ióny, ktoré tvoria základné oxidy silne zjednotené. To sťažuje roztavenie a ešte ťažšie sa odparuje. Z tohto dôvodu majú veľmi vysoké body fúzie a varu.
Sú pevné pri izbovej teplote
Kvôli rovnakej skutočnosti, že majú vysoké fúzne body, sú všetky základné oxidy pevné pri teplote miestnosti.
Sú to základné zlúčeniny
Dôvod, prečo sa nazývajú základné oxidy, je práve kvôli svojim vlastnostiam na báze kyseliny. Oxidy s väčším iónovým znakom produkujú základné roztoky pri rozpustení vo vode a tiež reagujú s kyselinami, neutralizujú ich.
Je však potrebné poznamenať, že nie všetky oxidy kovov sú základné. Niektoré sú neutrálne, iné kyseliny a iné amfotor.
Väčšina z nich je málo rozpustných alebo nerozpustných vo vode
Všetky základné oxidy sú nerozpustné vo vode, s výnimkou oxidov alkalických a bárnom kovov. Sú však rozpustné v kyslých roztokoch.
Ako sú základné oxidy?
Základné oxidy sa môžu vytvárať spontánne, keď sú kovy vystavené kyslíku vzduchu. V skutočnosti korózne vrstvy, ktoré sa tvoria na povrchu kovov, pozostávajú z rôznych základných oxidov.
Zapojený kov, vo všeobecnosti je to alkalický, alkalický kov alebo prechodný kov.
Môžete napísať tri všeobecné reakcie na tvorbu oxidov v závislosti od toho, či je kovová Valencia párne alebo čudná:
Pre kovy s nepárnymi valenciami:
Keď má kov zvláštna valencia, všeobecná reakcia tvorby oxidu je:

Napríklad na tvorbu oxidu sodného, kde sodík má Valencia +1, je reakcia:
Môže vám slúžiť: fosfor: História, vlastnosti, štruktúra, získanie, použitie, použitia
Ďalším príkladom je tvorba oxidu železitého, v ktorom má železo oxidáciu alebo Valencia +3. V tomto prípade je reakcia:

Pre kovy s Valencia +2:
Keď má kov Valencia +2, všeobecná reakcia tvorby oxidu je:

Napríklad v prípade tvorby oxidu vápenatého, kde vápnik má Valencia +2, je reakcia:

Pre kovy s inými pármi:
Ak má kov okrem +2 rovnomerné valencie, všeobecná reakcia tvorby oxidu je:
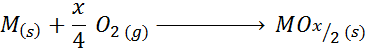
Príkladom tohto prípadu je reakcia tvorby oxidu titánu (IV):

Nomenklatúra základných oxidov
Existujú tri systémy nomenklatúry pre základné oxidy, ktoré sú: tradičná nomenklatúra, zásoby a systematické.
Na vymenovanie oxidu podľa prvých dvoch systémov nomenklatúry je potrebné poznať kovovú valenciu, zatiaľ čo posledný.
Tradičná nomenklatúra
Podľa tradičnej nomenklatúry sa základné oxidy pomenujú začínajúc slovom aniXido nasledované názvom katiónu. Toto priezvisko je vytvorené umiestnením koreňa kovového názvu a systému predpony a prípon označených kovovou valenciou:
Oxid + Predpona-raí-sufijo
Pravidlá priradenia predpon a prípon sú zhrnuté v nasledujúcej tabuľke:
Počet možných valencií | Valencia | Predpona | Prípona |
1 Single Valencia | |||
Iba | --- | ___ico | |
2 Valencias | |||
Starší | --- | ___ico | |
Menší | --- | ___ | |
3 valencie | |||
Starší | --- | ___ico | |
Stredne pokročilý | --- | ___ | |
Menší | Hiccup___ | ___ | |
4 valencie | |||
Starší | Za___ | ___ico | |
Hlavný | --- | ___ico | |
Stredne pokročilý | --- | ___ico | |
Menší | Hiccup___ | ___ico |
Príklad:
On Vernosť2Ani3 Je to oxid železa s Valencia +3. Železo má iba dve valencie, ktoré sú +2 a +3, takže v tomto oxide má železo najstaršiu z dvoch valencií. Z tohto dôvodu sa prípona pridáva ___ico v koreni mena železného kovu, ktorý je Bludník-.
Môže vám slúžiť: žiadne elektrolyty: charakteristiky a príkladyPreto tradičný názov Vernosť2Ani3 je: Oxid železita.
Nomenklatúra
V tomto systéme je názov zostavený začínajúcimi slovami oxid z, nasledované menom kovu. Nakoniec je jeho Valencia umiestnený v rímskych číslach v zátvorkách:
Kov + názov oxidu (Valencia)
V prípade, že kov má iba jednu valenciu, je vynechaný.
Príklad:
V CR2Ani3 Chromium má Valencia +3, takže názov je zásoba Oxid chróm (III).
Systematická nomenklatúra
Toto je jediný z troch nomenklatúry, ktoré nešpecifikujú kovové valencia. Sitematické názvy označujú, koľko atómov kyslíka a kovov obsahuje zlúčeninu pomocou číselných predponov.
Názov je zostavený so slovom oxid predchádza mu predpona označujúca počet kyslíka, Potom článok z nasledovaný Kovový názov s príslušnou predponou.
Predpona oxid + OF + predpona kovu
Niektoré predpony sú:
Počet | Predpona |
1 | Buchta |
2 | Dal |
3 | Trik |
4 | Tetra |
5 | Penta .. |
Príklad:
V systematickej nomenklatúre CR2Ani3 Nazýva sa dichroma trioxid, pretože má tri kyslík a dva chromos.
Príklady základných oxidov
- Oxid sodný - NA2Ani
- Oxid železitý - viera2Ani3
- Železná oxid - škaredý
- Cromický oxid - Cr2Ani3
- Divanadio pentaoxid - V2Ani5
- Oxid draselný - K2Ani
- Oxid bária - bao

