Oxid perchlorky (CL2O7)
- 1789
- 471
- Václav Višňovský
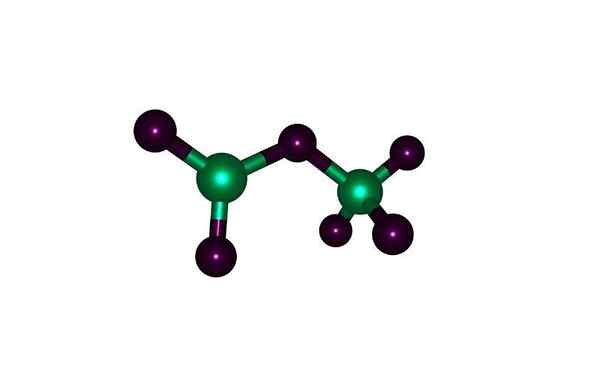
 Tyče a gule molekuly perclorického oxidu: zelené gule sú chlór a kyslíková čierna. S licenciou
Tyče a gule molekuly perclorického oxidu: zelené gule sú chlór a kyslíková čierna. S licenciou Čo je percologický oxid?
On Oxid, Nazýva sa tiež oxid chlóru (VII), dicloro alebo heptaoxid heptaxid,Je to anorganická chemická zlúčenina vzorca cl2O7, tvorené atómami chlóru a kyslíka.
Je to jeden z najstabilnejších oxidov chlóru a reaguje s vodou za vzniku kyseliny chloristovej:
Cl2Ani7 + H₂o d 2hclo4
Zlúčenina sa získa starostlivo dehydratáciou kyseliny percrórovej s fosforovým pentoxidom pri -10 ° C.
2HCLO4 + P2Ani5 ”CL2Ani7 + 2hpo3
Zlúčenina je destilovaná, aby sa oddelila od kyseliny metafosforečnej s veľkou opatrnosťou vzhľadom na výbušnú povahu. Môže byť tiež vytvorený osvetlením v zmesiach chlóru a ozónu.
Fyzikálne a chemické vlastnosti oxidu chlorista
- Oxid chlóru (VII) je bezfarebná, prchavá a mastná kvapalina.
- Jeho molekulová hmotnosť je 182,9 g/mol, jej hustota je 1.900 kg/m³ a body fúzie a varu sú -91,57 ° C a 82 ° C, respektíve.
- Je spontánne výbušné ovplyvniť alebo v kontakte s plameňom, najmä v prítomnosti jeho výrobkov rozkladu.
- Heptaoxid chlóru sa rozpúšťa v tetrachloridu uhličitého pri teplote miestnosti a reaguje s vodou za vzniku kyseliny percrine. Explodujte do kontaktu s jódom.
- Za normálnych podmienok je stabilnejší, hoci s menšou oxidačnou silou ako ostatné oxidy chlóru. Napríklad, keď je studená, neútočí na síru, fosfor alebo papier.
- Dikloro heptaoxid je silne kyslý oxid a v roztoku tvorí rovnováhu s kyselinou percrourovou kyselinou. Tvorba chlorrviny v prítomnosti hydroxidov alkalických kovov.
- Jeho tepelný rozklad sa vytvára monomolekulárnou disociáciou chlóru a radikálneho trioxidu.
Môže vám slúžiť: etylacetátRiziká
Oxid z perchlorky je nestabilná zlúčenina. Pri skladovaní sa pomaly rozkladá, s výrobou farebných výrobkov rozkladu, ktoré sú nižšie oxidy chlóru.
Je spontánne výbušný, najmä v prítomnosti svojich produktov rozkladu, nezlučiteľné s redukčnými činidlami, kyselinami a silnými základňami.
Aj keď je to najstabilnejší oxid chlóru, CL2Ani7, Je to silná oxidačná látka, ako aj výbušnina, ktorú je možné vypnúť plameňom alebo mechanickým šokom alebo kontaktom s jódom.
Je však menej oxidačný ako ostatné oxidy chlóru a neútaví síru, fosfor alebo papier, keď je studený. Má rovnaké účinky na ľudské telo ako elementárny chlór a vyžaduje rovnaké opatrenia.
Požitie spôsobuje silné popáleniny v ústach, pažeráku a žalúdku. Para je inhaláciou veľmi toxická.
V prípade kontaktu s očami musíte overiť, či sa používajú kontaktné šošovky, a okamžite ich odstráňte. Oči by mali byť opláchnuté tečúcou vodou najmenej 15 minút, pričom viečka sú otvorené. Môže byť použitá studená voda bez podania očnej masy.
Ak chemikália príde do styku s oblečením, zachovajte ju čo najrýchlejšie a chráňte svoje vlastné ruky a telo. Položte obeť pod bezpečnostnú sprchu.
Ak sa chemická látka hromadí v exponovanej pokožke obete, ako sú ruky, pokožka kontaminovaná tečúcou vodou a neabrazzívne mydlo je jemne umyté a opatrne.
Môže sa použiť studená voda. Ak podráždenie pretrváva, vyhľadajte lekársku pomoc. Pred opätovným použitím umyte kontaminované oblečenie.
Môže vám slúžiť: rovnocenná váhaV prípade vdýchnutia by sa obeť mala nechať stáť v dobre vetranej oblasti. Ak je inhalácia vážna, obeť sa musí čo najskôr evakuovať do bezpečnej oblasti.
Voľné pevné oblečenie, ako je krk košele, opasky alebo kravata. Ak je obeť ťažké dýchať, musí sa podávať kyslík.
Ak obeť nedýcha, urobí sa resuscitácia úst v ústach. Vždy berúc do úvahy, že to môže byť nebezpečné pre osobu, ktorá poskytuje pomoc pri poskytovaní resuscitácie úst, keď je vdýchnutý materiál toxický, infekčný alebo korozívny.
Vo všetkých prípadoch by sa mala hľadať okamžitá lekárska starostlivosť.
Žiadosti
- Oxid perchlorky nemá praktické aplikácie. Mohlo by sa použiť ako oxidačné činidlo alebo na výrobu kyseliny chlorovej, ale jej výbušná povaha sťažuje jej manipuláciu.
- Dikloro heptaoxid sa môže použiť ako činidlo na produkciu chloristaných alebo na štúdium s rôznymi reakciami.
- V práci Kurta Baum sa študovali reakcie oxidu chlorista s olefínmi, alkoholmi, jodidmi alkyl a perchlorátu acylu esteru, ktoré získali halogenácie a oxidácie.
- V prípade druhého produkuje alklore reagujúce s jednoduchými alkoholmi, ako je etylénglykol, 1, 4-butadienol, 2, 2, 2-trifluóretanol, 2, 2-dinitropropanol. Reaguje s 2-propanolom, čím sa poskytuje izopropyl percelácia. 2-hexanol a 3-hexanol dávajú tlačidlo bez dohody a ich príslušné ketóny.
- Propeno reaguje s dichlór heptaoxidom v tetrachloridu uhličitého, čím sa poskytuje izopropyl percelorate (32%) a 1clor, 2-propylperclorato (17%). Zlúčenina reaguje s Cis-Buteno na poskytnutie perchlorátu 3-chlórrobutil (30%) a 3-Zo, 2-butil percelorate (7%).
Môže vám slúžiť: kryštalická štruktúra- Dikloro heptaoxid reaguje s primárnymi a sekundárnymi amínmi v roztoku tetrachloridu uhlíka, čím sa dá N-perkoláty:
2 RNH2 + CL2O7 → 2 RNHCLO3 + H₂O
2 R2NH + CL2O7 → 2 R2NCLO3 + H₂O
- Reaguje tiež s alkénmi, aby poskytla alkyl percloráty. Napríklad reaguje s propeno v roztoku tetrachloridu uhlíka, aby sa vytvoril izopropylblorát a perclorato 1-bunky-2-propil.
Odkazy
- Egon Wiberg, n. W. (2001). Anorganická chémia. Academic Press: Londýn.
- (2009). Heptoooxid dichlóru. Zdroj: chebi: EBI.Ac.Uk.

