Štruktúra oxidu titánu (IV), vlastnosti, používa

- 4232
- 553
- Ing. Ervín Petruška
On oxid titánu (IV) Je to kryštalická biela anorganická tuhá látka, ktorej chemický vzorec je strýko2, Takže je známy tiež ako oxid titaničitý. Existuje v troch kryštalických formách: Rutilo, Anatasa a Brookita. Aj keď je v prírode zvyčajne zafarbený kvôli prítomnosti nečistôt, ako je železo, chróm alebo vanadium, strýko2 čistý sa používa ako biely pigment.
Medzi jeho charakteristikami môžeme zdôrazniť, že rozpustnosť strýka2 Závisí to od jeho chemickej a tepelnej histórie. Ako aj to, že keď sa zahrieva na vysoké teploty (900 ° C), stáva sa chemicky inertný. Jeho najdôležitejšími zdrojmi sú ilmenit (oxid železa a titány), rutilo a anatáza.
 Titaničitý oxid prach. Originálny uploader bol Walkerma na anglickej Wikipédii. [Verejná doména]
Titaničitý oxid prach. Originálny uploader bol Walkerma na anglickej Wikipédii. [Verejná doména] Vyskytuje sa hlavne v primeranej miere na použitie ako pigment, čo zaručuje jeho vynikajúce vlastnosti disperznosti svetla v aplikáciách, ktoré vyžadujú bielu nepriehľadnosť a jas.
Vyskytuje sa tiež ako ultrajemný materiál, pre aplikácie, v ktorých sa vyžaduje priehľadnosť a maximálna absorpcia ultrafialových lúčov (UV). Napríklad ako súčasť opaľovacích krémov pre pokožku. V nich strýko2 Pôsobí ako filter, a tak blokuje absorpciu týchto lúčov.
Vďaka svojej chemickej zotrvačnosti je to preferovaný biely pigment. Avšak Spojené štáty americké Administration Food and Drugs alebo FDA (skratka pre angličtinu Alebo.Siež. Úrad pre potraviny a liečivá) stanovil parametre pre bezpečné použitie v potravinách a kozmetike.
Existuje tiež limit vystavenia prachu oxidu titánu, pretože keď je prach vdýchnutý, môže sa uložiť do pľúc.
Môže vám slúžiť: kalkogény alebo ampumos[TOC]
Štruktúra
Strýko2 Má tri kryštalické úpravy: Rutilo, Anatasa a Brookita. Tieto kryštalické odrody sú v prírode.
Ruka
Rutho kryštalizuje v tetragonálnom systéme s dvoma jednotkami TIO2 pre každú bunku. Titán je koordinovaný oktaéconicky. Ukázalo sa to kalorimetrickými štúdiami, že Rutilo je najstabilnejšia kryštalická forma.
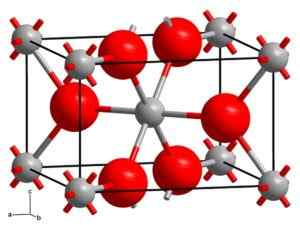 Kryštalická štruktúra rutilo. Šedé gule: titán, ružové gule: kyslík. Pevný stav [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Zdroj: Wikipedia Commons
Kryštalická štruktúra rutilo. Šedé gule: titán, ružové gule: kyslík. Pevný stav [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Zdroj: Wikipedia Commons Anatasa
Táto forma kryštalizuje v tetragonálnom systéme, ale anatáza je prezentovaná vo forme veľmi zdeformovaných októmov atómov kyslíka s ohľadom na každý atóm titánu, pričom dva z nich sú relatívne najbližšie. Má 4 jednotky strýka2 Pre každú kryštalickú bunku.
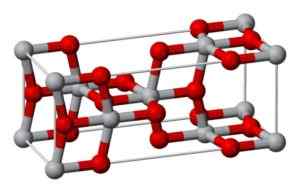 Kryštalická štruktúra anatázy. Benjah-Bmm27 [verejná doména] Zdroj: Wikipedia Commons
Kryštalická štruktúra anatázy. Benjah-Bmm27 [verejná doména] Zdroj: Wikipedia Commons Brookita
Kryštalizuje v orcombickom systéme s 8 jednotkami TIO2 Pre každú kryštalickú bunku.
Vlastnosti
Fyzický stav
Kryštalický tuhý.
Mohs tvrdosť
Rutilo: 7-7.5.
Anatasa: 5.5-6.
Molekulová hmotnosť
79,87 g/mol.
Bod topenia
Rutilo: 1830-1850 ° C.
Anatasa: Keď sa zahrievanie stane rutilo.
Hustota
Rutilo: 4 250 g/cm3
Anatasa: 4 133 g/cm3
Brookita: 3 895 g/cm3
Rozpustnosť
Nerozpustné vo vode a organických rozpúšťadlách. Sa pomaly rozpúšťa v HF a H2SW4 Horúci koncentrát. Nerozpustný v HCl a Hno3.
pH
7.5.
Index lomu
Rutilo: 2,75 až 550 nm.
Anatasa: 2,54 až 550 nm.
Má najvyšší index lomu všetkých anorganických pigmentov.
Ďalšie vlastnosti
Anatáza sa rýchlo transformuje na rutilo pri teplotách nad 700 ° C. Strýko2 ktorý bol kalcinovaný pri 900 ° C, sa rozpustí slabo v bázách, fluorhorrickej kyseline a kyseline sírovej horúcej sírovej. Nie je napadnutá slabými anorganickými kyselinami alebo organickými kyselinami. Nie je ľahko znížená alebo oxidovaná.
Môže vám slúžiť: Scandio: História, vlastnosti, reakcie, riziká a použitiaAnatáza a rutil.
Menovanie
-Oxid titaničitý
-Ruka
-Anatasa
-Brookita
-Titánia
Žiadosti
Biele pigmenty
Najdôležitejšie použitie oxidu titánu (IV) je ako biely pigment v rôznych produktoch, ktoré zahŕňajú farby, lakky, lepidlá, plasty, papier a tlačiarenské atramenty. Je to kvôli jeho vysokému indexu lomu a chemickej zotrvačnosti.
 Zdroj: pexels.com
Zdroj: pexels.com Oxid titaničitý používaný ako biely pigment musí mať vysokú čistotu. Jeho nepriehľadnosť a jas odvodzujú z jeho schopnosti rozptýliť svetlo. Je jasnejší ako diamant. Iba Rutilo a Anatas majú dobré pigmentačné vlastnosti.
Plasty
V plastoch strýko2 Minimalizuje krehkosť a krakovanie, ktoré sa môžu vyskytnúť v dôsledku vystavenia svetlu.
Je to najdôležitejší pigment pri výrobe vonkajších plastových položiek PVC, pretože poskytuje materiálovú ochranu UVR.
Optimálna kryštalická forma v tomto prípade je rutilo. V tejto aplikácii musí mať rutilo povrchový povlak zirkónia, oxidu kremičitého alebo hliníka, aby sa minimalizoval fotokatalytický účinok strýka2 V degradácii PVC.
Iné použitia
Medzi ďalšie použitia patrí sklovitá sklovina používaná v roztavenej oceli a železniu, ktorá poskytuje opacitu a odolnosť proti kyseline.
V textilnom priemysle sa používa v vodiacich vláknach, takže sa počas priadze ľahko posúvajú. Trenie medzi vláknami a sprievodcami vytvára statickú elektrinu. Aby to rozptýlilo, strýko2 Musí sa spáliť pri 1300 ° C, aby mal väčšiu elektrickú vodivosť.
Môže vám slúžiť: lítium fluorid: štruktúra, vlastnosti, získanie, použitiaMedzi ďalšie aplikácie patrí atramentová pigmentácia pre tlač. Ako papierový náter strýko2 Vďaka tomu je belší, jasný a nepriehľadnejší.
Používa sa v kozmetike, aby pomohla pokryť nedokonalosti pokožky, ako aj na poskytnutie bielej zubnej pasty a mydle.
Umožňuje chrániť jedlo, nápoje, doplnky a farmaceutické výrobky pred predčasnou degradáciou produkovanou vplyvom svetla, predĺženia životnosti produktu.
Je súčasťou výroby skla, keramiky a elektrokeramiky. Používa sa v prvkoch elektrických obvodov. Používa sa tiež v kyslíkovom senzore výfukového systému motorových vozidiel.
Strýko2 Ultrafino sa používa ako súčasť blokátorov slnka, pretože je to silný absorbent ultrafialových lúčov (UV), UV-A aj UV-B. UV-A lúče spôsobujú vrásky a starnutie pokožky a UV-B spôsobujú popáleniny a erytémy.
Nanočastice strýka2 Používajú sa ako chemické reakcie katalyzátorový materiál.
Anatázia je fotokatizácia účinná, ktorá oxiduje organické zlúčeniny. Zatiaľ čo maloleté sú jeho častice, tým efektívnejšie sú.
Odkazy
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. John Wiley & Sons.
- Kirk-Othmer (1994). Encyklopédia chemickej technológie. Zväzok 19 a 24. Štvrté vydanie. John Wiley & Sons.
- Fakty o chemickej bezpečnosti. (2019). Oxid titaničitý. Získané z: ChemicalSaFetyFacts.orgán
- Wypych, George. (2015). Prísady PVC. Vo vzorci PVC (druhé vydanie). Zotavené z vedeckých pracovníkov.com
- Denning, r. (2009). Vylepšovanie výrobkov vlny pomocou nanotechnológie. V pokroku vo vlnenej technológii. Zotavené z vedeckých pracovníkov.com
- Lekárska knižnica. (2019). Oxid titaničitý. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- « Funkcia profilu štítnej žľazy hormónov, dôležitosť, kvantifikácia
- Chulachaqui Charakteristiky a legenda »

