Štruktúra oxidu kremíka (SIO2), vlastnosti, použitia, získanie

- 3243
- 952
- Gabriel Bahna
On oxid kremičitý Je to anorganická tuhá látka tvorená spojením atómu kremíka a dvoch kyslíka. Jeho chemický vzorec je SIO2. Táto prírodná zlúčenina sa tiež nazýva kremík alebo oxid kremíka.
SIO2 Je to najhojnejší minerál v zemskej kôre, pretože piesok sa skladá z oxidu kremičitého. Podľa jej štruktúry môže byť oxid kremičitý kryštalickým alebo amorfným. Je nerozpustný vo vode, ale rozpúšťa sa v alkálii a vo fluorhotickej kyseline HF.
 Piesok je zdrojom oxidu oxidu kremíka2. ರವಿಮುಂ [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons.
Piesok je zdrojom oxidu oxidu kremíka2. ರವಿಮುಂ [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons. SIO2 Je tiež prítomný v štruktúre určitých rastlín, baktérií a húb. Tiež v kostrách morských organizmov. Okrem piesku existujú aj ďalšie typy kameňov, ktoré sú oxidom kremičitým.
Oxid kremičitý má veľmi rozšírené použitie a plní rôzne funkcie. Najrozšírenejšie používanie je ako filtračný materiál tekutín, ako sú oleje a ropné výrobky, nápoje, ako je pivo a víno, ako aj ovocné šťavy.
Ale má mnoho ďalších aplikácií. Jedným z najužitočnejších a najdôležitejších je výroba bioaktívneho skla, ktoré umožňuje „lešenie“, kde kostné bunky rastú, čo produkuje chýbajúce časti kostí v dôsledku nehody alebo choroby.
[TOC]
Štruktúra
Oxid kremičitý2 Je to molekula s tromi atom, v ktorej je atóm kremíka spojený s dvoma atómami kyslíka s kovalentnými väzbami.
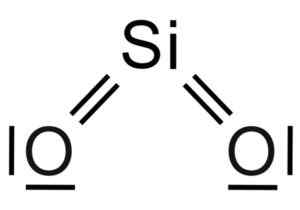 Chemická štruktúra molekuly SIO2. Grasso Luigi [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons.
Chemická štruktúra molekuly SIO2. Grasso Luigi [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons. Štrukturálna jednotka tuhého oxidu kremičitého ako tatrahedron, kde je atóm kremíka obklopený 4 atómami kyslíka.
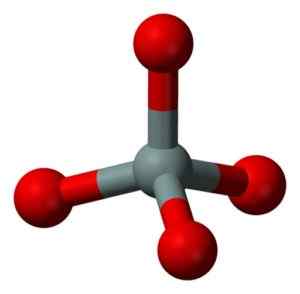 Štrukturálna jednotka pevného oxidu kremičitého: šedá = kremík, červená = kyslík. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons.
Štrukturálna jednotka pevného oxidu kremičitého: šedá = kremík, červená = kyslík. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons. Tetrahedra sa navzájom viaže a zdieľajúc atómy kyslíka svojich susediacich vrcholov.
Preto atóm kremíka zdieľa v polovici každého zo 4 atómov kyslíka, čo vysvetľuje pomer v zlúčenine 1 atómu kremíka pri 2 atómoch kyslíka (SIO (SIO SIO2).
 Tetrahedra zdieľa kyslík v SIO2. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons.
Tetrahedra zdieľa kyslík v SIO2. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons. Zlúčeniny2 Sú rozdelené do dvoch skupín: kryštalický oxid kremičitý a amorfný oxid kremičitý.
Kryštalické zlúčeniny oxidu kremičitého majú štruktúry s opakovanými vzormi kremíka a kyslíka.
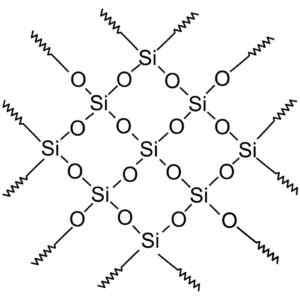 Kryštalický oxid kremičitý má opakujúce sa jednotky. Wersję rastrową wykonał użytkownik Polskiego Projektu wikipedii: Polyicerek, Zwektoryzował: Krzysztof Zajączkowski [GFDL (http: // www.GNU.Org/copyleft/fdl.html)]. Zdroj: Wikimedia Commons.
Kryštalický oxid kremičitý má opakujúce sa jednotky. Wersję rastrową wykonał użytkownik Polskiego Projektu wikipedii: Polyicerek, Zwektoryzował: Krzysztof Zajączkowski [GFDL (http: // www.GNU.Org/copyleft/fdl.html)]. Zdroj: Wikimedia Commons. Celý kremičitý kryštál možno považovať za obrovskú molekulu, kde je kryštalická sieť veľmi silná. Tetrahedra môže byť spojená rôznymi spôsobmi, čo vedie k rôznym kryštalickým formám.
Môže vám slúžiť: siete Bravais: Koncept, charakteristiky, príklady, cvičeniaV amorfnom silike sú štruktúry náhodne prepojené, bez toho, aby sledovali pravidelný vzorec medzi molekulami a sú v inom priestorovom vzťahu jeden medzi sebou.
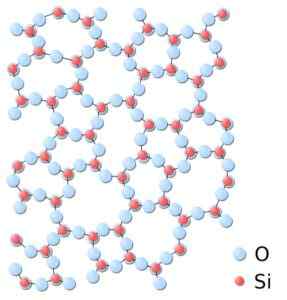 V amorfnom silike nie sú odbory opakované alebo jednotné. Oxid kremičitý.SVG: *oxid kremičitý.JPG: In: Používateľ: JDrewittDerivevatívne dielo: Matt [Public Domain]. Zdroj: Wikimedia Commons.
V amorfnom silike nie sú odbory opakované alebo jednotné. Oxid kremičitý.SVG: *oxid kremičitý.JPG: In: Používateľ: JDrewittDerivevatívne dielo: Matt [Public Domain]. Zdroj: Wikimedia Commons. Menovanie
-Oxid kremičitý
-Oxid kremičitý
-Oxid kremičitý
-Štrbina
-Tridimita
-Cristobalita
-Dioxosilano
Vlastnosti
Fyzický stav
Farba bezfarebná až šedá.
 Vzorka2 čistý. Lhchem [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
Vzorka2 čistý. Lhchem [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons. Molekulová hmotnosť
60 084 g/mol
Bod topenia
1713 ° C
Bod varu
2230 ° C
Hustota
2,17-2,32 g/cm3
Rozpustnosť
Nerozpustné vo vode. Amorfný oxid kremičitý je rozpustný v alkálii, najmä ak je jemne rozdelený. Rozpustný vo fluórhorickej kyseline HF.
Amorfný oxid kremičitý je menej hydrofilný, to znamená menej súvisí s vodou ako kryštalická.
Chemické vlastnosti
SIO2 o oxid kremičitý je v podstate inertný pre väčšinu látok, je veľmi málo reaktívneho.
Odoláva útoku chlóru CL2, Bromo br2, Vodík H2 a väčšiny kyselín pri izbovej teplote alebo mierne vyššie. Je napadnutý fluór f2, Kyselina fluorhorhorická kyselina a alkalis, ako je uhličitan sodný2Co3.
SIO2 Môže sa kombinovať s kovovými prvkami a oxidmi, aby sa vytvorili kremičitany. Ak sa oxid kremičitý topí s alkalickými kovovými uhličitami pri približne 1300 ° C, získajú sa alkalické kremičitany a CO2.
Nie je to palivo. Má nízku tepelnú vodivosť.
Prítomnosť v prírode
Hlavným zdrojom oxidu kremičitého v prírode je piesok.
SIO2 o Silica je vo forme troch kryštalických odrôd: kremeň (najstabilnejší), tridimita a cristobalita. Amorfant pre oxid kremičitý sú Agata, Jaspe a ónce. Opál je amorfný hydratovaný oxid kremičitý.
Existuje tiež takzvaná biogénna oxid kremičitý, to znamená ten, ktorý vytvára živé organizmy. Zdroje tohto typu oxidu kremičitého sú baktérie, huby, diatómy, morské špongie a rastliny.
Jasné a tvrdé časti bambusu a slama obsahujú oxid kremičitý a kostry niektorých morských organizmov majú tiež veľkú časť oxidu kremičitého; Najdôležitejšie sú však diatomátory.
Diatomea Lands sú geologické produkty rozpadnutých jednobunkových organizmov (riasy).
Môže vám slúžiť: kozmický prachIné typy prírodných oxid kremičitý
V prírode existujú aj nasledujúce odrody:
- Sklovité kremíky, ktoré sú sopečné sklo
- Millerity, ktoré sú prírodné sklo produkované fúziou kremičitého materiálu pod vplyvom meteoritov
- Roztavený oxid kremičitý, ktorý je zahrievaný oxid kremičitý do kvapaliny a ochladenej fázy bez toho, aby umožnil kryštalický
Získanie
Oxid kremičitý z arénov sa získava priamo z lomov.
 Lom aréna v Kalifornii. Ruff Tux Cream Puff [CC0]. Zdroj: Wikimedia Commons.
Lom aréna v Kalifornii. Ruff Tux Cream Puff [CC0]. Zdroj: Wikimedia Commons. Týmto spôsobom sa tiež získavajú diatomit alebo diatomy, s použitím podobných rýpadiel a zariadení.
Amorfný oxid kremičitý sa pripravuje na základe vodných roztokov silikátov alkalických kovov (ako je sodný Na) neutralizáciou kyselinou, ako je kyselina sírová H2SW4, HCl kyselina chlorovodíková alebo oxid uhličitý2.
Ak je konečné pH roztoku neutrálne alebo alkalické, získa sa vyzrážaný oxid kremičitý. Ak je pH kyslé, získa sa gélový oxid kremičitý.
Pyrogénny oxid kremičitý sa pripravuje spaľovaním prchavej kremíkovej zlúčeniny, obvykle kremíkového sikl -tetrachloridu4. Zrážaný oxid kremičitý sa získa z vodného roztoku kremičitanov, ku ktorému sa kyselina pridáva.
Koloidný oxid kremičitý je stabilnou disperziou amorfných koloidných častíc amorfného oxidu kremičitého vo vodnom roztoku.
Žiadosti
V niekoľkých aplikáciách
Oxid kremičitý2 Má širokú škálu funkcií, napríklad slúži ako drsné, absorpčné, antiapelmazante, plnené, zakaliace sa a uprednostňujú pozastavenie iných látok, medzi mnohými ďalšími spôsobmi zamestnania.
Používa sa napríklad:
-V skle, keramickom, refraktérnom, abrazívnom a rozpustnom skle
-Sfarbenie a čistenie olejov a ropných výrobkov
-Vo formách pre zlievárne
-Ako antiapelmazante práškov všetkého druhu
-Ako antispumant
-Na filtrovanie tekutín, ako sú rozpúšťadlá pre umývanie, voda z bazénov a obecných a priemyselných odpadových vôd
-Pri výrobe tepelných izolátorov, ohnivých tehál a obalových materiálov odolných voči ohňom a kyselinám
-Ako vyplnenie výroby papierov a kariet, aby boli odolnejšie
-Ako je naplnené obrazmi, aby sa zlepšil jeho tok a farba
-V materiáloch na leštenie kovov a drevo, pretože im dávajú brúseniu
-V laboratóriách chemickej analýzy v chromatografii a ako absorbent
-Ako antiapelmazante insekticídov a agrochemických vzorcov, aby pomohli brúsiť pesticídnu a ako nosič aktívnej zlúčeniny
-Ako katalyzátorová podpora
-Ako výplň na posilnenie syntetickej gumy a gumy
Môže vám slúžiť: Pozdĺžne vlny: Charakteristiky, rozdiely, príklady-Ako nosič tekutín v potravinách pre zvieratá
-V tlačených atramentoch
-Ako suší a adsorbent, vo forme silikagélu
-Ako aditívna v cemente
-Ako domáce zviera
-V mikroelektronických izolátoroch
-V termoptických prepínačoch
 Silikagél. Kenpei [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/]]. Zdroj: Wikimedia Commons.
Silikagél. Kenpei [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/]]. Zdroj: Wikimedia Commons. V potravinárskom priemysle
Amorfný oxid kremičitý je začlenený do rôznych potravinárskych výrobkov ako multifunkčná priama zložka do rôznych druhov potravín. Nemali by ste prekročiť 2% hotového jedla.
Napríklad slúži ako antiapelmazante (aby sa zabránilo prilepeniu určitých potravín), ako stabilizátor vo výrobe piva ako antiprecipitátora na filtrovanie vína, piva a ovocia šťavy alebo zeleniny.
 Tím pre filtrovanie vína s diatommi (SIO2). Fabio Ingroso [CC by 2.0 (https: // creativeCommons.Org/licencie/BY/2.0)]. Zdroj: Wikimedia Commons.
Tím pre filtrovanie vína s diatommi (SIO2). Fabio Ingroso [CC by 2.0 (https: // creativeCommons.Org/licencie/BY/2.0)]. Zdroj: Wikimedia Commons. Pôsobí ako tekutina absorpcia v niektorých potravinách a zložka mikrokapsúl na ochucovacie oleje.
Okrem toho SIO2 Amorfous sa aplikuje špeciálnym procesom na povrchu plastov článkov na zabalenie potravín, ktoré pôsobia ako bariéra.
Vo farmaceutickom priemysle
Pridáva sa ako antiapelmazante činidlo, zahusťovanie, gelovanie a pomocník, to znamená ako asistent formovať niekoľko liekov a vitamínov.
V kozmetickom priemysle a osobnej starostlivosti
Používa sa v množstve výrobkov: v práškoch tváre, očných tieňoch, očných očných oka, rúžov, sfarbenia, make -upu, mastenca, prášku pre nohy, farbenia vlasov a bielidlá a bielidlá a bielidlá a bielidlá a bielidlá.
Tiež v olejoch a kúpeľoch, penových kúpeľoch, rukách a telovej kréme.
Tiež v nočných hydratačných krémoch, jas a farbe nechtov.
V terapeutických aplikáciách
SIO2 Je prítomný v bioaktívnom alebo biovidriosovom skle, ktorého hlavnou charakteristikou je, že môžu chemicky reagovať s biologickým prostredím, ktoré ich obklopuje, a vytvára silné a odolné spojenie so živým tkanivom.
Tento typ materiálu slúži na výrobu náhrad kostí, ako sú napríklad postihnutia tváre, ako napríklad „lešenie“, v ktorom budú kostné bunky rásť. Preukázali dobrú biokompatibilitu s kosťami a mäkkými tkanivami.
Tieto Biovidrios umožnia obnoviť kosti z tváre ľudí, ktorí ich stratili náhodou alebo chorobou.
Riziká
Veľmi tenké častice oxidu kremičitého môžu byť suspendované vo vzduchu a tvoria neexplózne prášky. Ale tento prach môže dráždiť pokožku a oči. Jeho vdýchnutie spôsobuje podráždenie dýchacích ciest.
Okrem toho inhalácia prachu oxidu kremičitého spôsobuje dlhodobé poškodenie pľúc, nazývané silikóza.
Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Oxid kremičitý. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Da Silva, m.R. a kol. (2017). Techniky zelenej extrakcie. Sorbnty na báze oxidu kremičitého. Pri porozumení analytickej chémie. Zotavené z vedeckých pracovníkov.com.
- Ylänen, h. (editor). (2018). Bioaktívne okuliare: materiály, vlastnosti a aplikácie (druhé vydanie). Elsevier. Zotavené z kníh.Riadenie.co.ísť.
- Windholz, m. a kol. (redaktori) (1983) Merck Index. Encyklopédia chemikálií, dragov a biologických látok. Desiate vydanie. Merck & Co., Inc.
- Mäkinen, J. A suni, t. (2015). Doštičky s hrubým filmom SOI. V príručke materiálov a technológií MEMS založených na kremíku (druhé vydanie). Zotavené z vedeckých pracovníkov.com.
- Sirleto, L. a kol. (2010). Termo-optické prepínače. Kremíkové nanokryštály. Zotavené z vedeckých pracovníkov.com.
- « Štruktúra fluoridu vápenatého (CAF2), vlastnosti, používa
- 275 Pyropos pre romantických a sexy mužov »

