Štruktúra fluoridu vápenatého (CAF2), vlastnosti, používa

- 4486
- 1342
- Blažej Hrmo
On fluorid vápenatý Je to anorganická tuhá látka tvorená atómom vápnika (CA) a dvoma atómami fluóru (F). Jeho chemický vzorec je kaviareň2 A je to kryštalická šedá -biela pevná látka.
V prírode sa nachádza vo fluoritovej rudi alebo rozstrekovacom fluór. Existuje prirodzene v kosťoch a zuboch. Fluoritský minerál je hlavným zdrojom používaným na získanie ďalších zlúčenín fluóru.
 CAF fluorid2 tuhý. W: Používateľ: Walerma v júni 2005. Zdroj: Wikimedia Commons.
CAF fluorid2 tuhý. W: Používateľ: Walerma v júni 2005. Zdroj: Wikimedia Commons. Okrem toho káva2 Používa sa na prevenciu zubného kazu v zuboch, takže sa pridáva do materiálov používaných zubármi na ich vyliečenie. V skutočnosti sa do pitnej vody pridáva fluorid vápenatý (voda, ktorá sa môže opiť), takže populácia ťaží pri požití a čistení zubov.
Kaviareň2 Používa sa vo veľkých kryštáloch v optických zariadeniach a fotoaparátoch. Používa sa tiež v malých zariadeniach, ktoré slúžia na zisťovanie toho, do akej miery bol človek vystavený rádioaktivite.
[TOC]
Štruktúra
CAF fluorid2 Je to iónová zlúčenina tvorená katiónom vápnikov2+ a dve fluoridové lišty-. Niektoré zdroje informácií však naznačujú, že ich odkazy majú určitý kovalentný charakter.
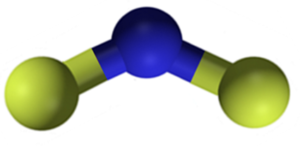 Štruktúra fluoridu vápnika CAF2. Modrá: vápnik; Žltý fluór. Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons.
Štruktúra fluoridu vápnika CAF2. Modrá: vápnik; Žltý fluór. Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons. Menovanie
Fluorid vápenatý
Vlastnosti
Fyzický stav
Sfarbenie tuhej až sivej bielej s kubickou kryštalickou štruktúrou.
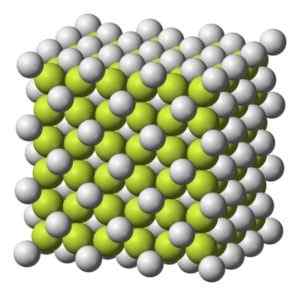 Kubická kryštalická štruktúra kávy2. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons.
Kubická kryštalická štruktúra kávy2. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons. Molekulová hmotnosť
78,07 g/mol
Bod topenia
1418 ° C
Bod varu
2533 ° C
Hustota
3,18 g/cm3 pri 20 ° C.
Index lomu
1 4328
Rozpustnosť
Je nerozpustný vo vode pri 20 ° C. Takmer nerozpustné pri 25 ° C: 0,002 g/100 ml vody. Mierne rozpustný.
Chemické vlastnosti
Jeho oxidačné alebo redukčné vlastnosti sú veľmi slabé, tieto reakcie sa však môžu vyskytnúť. Aj keď zvyčajne vo veľmi málo prípadoch.
Je inertný na organické chemické zlúčeniny a mnoho kyselín, vrátane kyseliny fluórhy HF. Pomaly sa rozpúšťa v kyseline dusičnej3.
Môže vám slúžiť: Millikan Experiment: Postup, vysvetlenie, dôležitosťNie je to horľavé. Nereaguje rýchlo so vzduchom alebo vodou.
Kvôli svojej malej afinite k vode, aj keď je vystavená vysokému percentu vlhkosti, nemá to vplyv na mesiac pri normálnej teplote miestnosti.
V prítomnosti vlhkosti sa steny ich kryštálov pomaly rozpustia pri teplotách nad 600 ° C. V suchom prostredí sa môže použiť až do asi 1000 ° C bez toho, aby sa výrazne ovplyvnilo.
Prítomnosť v prírode
CAF fluorid2 Prirodzene sa nachádza vo fluoride fluorite alebo rozstrekaného fluoridu.
Aj keď káva2 Pure je bezfarebný, minerál fluoritu je často zafarbený prítomnosťou elektrónov uväznených v „otvoroch“ kryštalickej štruktúry.
Tento minerál je vysoko ocenený pre svoj sklovitý jas a rozmanitosť farieb (fialová, modrá, zelená, žltá, bezfarebná, hnedá, ružová, čierna a červenkastá oranžová). Hovorí sa, že ide o „najfarbenejší minerál na svete“.
 Fluorit bane vo Francúzsku. Toulouse Muséum [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
Fluorit bane vo Francúzsku. Toulouse Muséum [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons. Fluorit (modré kryštály) prírodného múzea v Miláne. Giovanni Dall'orto [CC BY-SA 2.5 IT (https: // creativeCommons.Org/licencie/By-SA/2.5/It/skutok.in)]. Zdroj: Wikimedia Commons.
Fluorit (modré kryštály) prírodného múzea v Miláne. Giovanni Dall'orto [CC BY-SA 2.5 IT (https: // creativeCommons.Org/licencie/By-SA/2.5/It/skutok.in)]. Zdroj: Wikimedia Commons. Fluorit bane v Anglicku. Didier Descuens [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons.
Fluorit bane v Anglicku. Didier Descuens [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons. Fluorit bane vo Francúzsku. Didier Descuens [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
Fluorit bane vo Francúzsku. Didier Descuens [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
 Fluorit bane v USA. Autor: Oliveira Jurema. Zdroj: Wikimedia Commons.
Fluorit bane v USA. Autor: Oliveira Jurema. Zdroj: Wikimedia Commons. Fluorid vápenatý sa tiež nachádza v kostiach v množstvách medzi 0,2 a 0,65%a tiež v sklovine zubov v 0,33-0,59%.
Žiadosti
- Pri získavaní fluoridových zlúčenín
Fluorita2 Je to základný alebo väčšinový zdroj fluoridu na celom svete. Je surovinou pripraviť takmer všetky fluórne zlúčeniny.
Najdôležitejšie z nich je HF Fluorhoorická kyselina, z ktorej sa pripravujú ostatné fluorkované zlúčeniny. Fluorid ión f- Uvoľňuje sa z minerálu reakciou tohto s koncentrovanou kyselinou sírovou H2SW4:
Môže vám slúžiť: izomériaKaviareň2 (pevné) + h2SW4 (kvapalina) → puzdro4 (tuhé) + 2 HF (plyn)
- Starostlivosť o zuby
CAF fluorid2 Je to agent pre prevenciu zubov. Používa sa na fluorizáciu pitných vôd (vody, ktoré sa dajú piť) s týmto cieľom.
Okrem toho nízke koncentrácie fluoridu f- (Poradie 0,1 dielov na milión), ktoré sa používajú v denníkových pastoch a ústnych vodách.
 Fluorid vápenatý pomáha pri prevencii zubného kazu. Autor: Annalize Batista. Zdroj: Pixabay.
Fluorid vápenatý pomáha pri prevencii zubného kazu. Autor: Annalize Batista. Zdroj: Pixabay. Nanočastice CAF2 viac efektívne
Aj keď sa fluoridy používajú v zubných pastoch a opláchnutí, nízka koncentrácia vápnika (CA) v slinách spôsobuje, že sa netvoria ložiská kávy2 v zuboch najúčinnejším možným spôsobom.
Preto bol navrhnutý spôsob, ako získať kávový prach2 ako nanočastice.
Na to používa sušičku Rocío (z angličtiny Sušenec) Kde dve roztoky (jedno z CA (OH) vápenatého hydroxidu2 a jeden z fluoridu amónneho NH4F) Miešajú sa, keď sú striekané do fotoaparátu s prietokom horúceho vzduchu.
Potom nastane nasledujúca reakcia:
CA (OH)2 + NH4F → CAF2 (pevné) + NH4Oh
NH4Ach volatilizuje ako NH3 a h2O a nanočastice CAF zostávajú2.
Majú vysokú reaktivitu a väčšiu rozpustnosť, vďaka čomu sú účinnejšie pre seineralizáciu zubov a ako protichodníky.
- V objektíve pre optické vybavenie
Fluorid vápenatý sa používa na budovanie optických prvkov, ako sú hranoly a spektrofotometre infračerveného a ultrafialového svetla (UV).
Tieto zariadenia umožňujú meranie množstva svetla absorbovaného materiálom, keď cez neho prechádza.
Kaviareň2 V týchto oblastiach spektra svetla je transparentný, má extrémne nízky index lomu a umožňuje získať efektívnejšie rozlíšenie ako spektrum NaCl v intervale 1500-4000 cm-1.
Môže vám slúžiť: paramagnetizmusVďaka svojej chemickej stabilite môže podporovať nepriaznivé podmienky tak, aby optické prvky CAF2 Nie sú napadnutí. Má tiež vysokú tvrdosť.
V fotoaparátoch
Niektorí výrobcovia fotoaparátov používajú šošovky na kávu2 Umelá kryštalizovaná na zníženie disperzie svetla a dosiahnutie vynikajúcej korekcie skreslenia farieb.
 Niektoré fotoaparáty majú šošovky fluoridu vápnika CAF2 Na zníženie skreslenia farieb. Bill Ebbesen [CC o 3.0 (https: // creativeCommons.Org/licencie/o/3.0)]. Zdroj: Wikimedia Commons.
Niektoré fotoaparáty majú šošovky fluoridu vápnika CAF2 Na zníženie skreslenia farieb. Bill Ebbesen [CC o 3.0 (https: // creativeCommons.Org/licencie/o/3.0)]. Zdroj: Wikimedia Commons. - V metalurgickom priemysle
Kaviareň2 Používa sa ako zakladateľské činidlo v metalurgickom priemysle, pretože je zdrojom nerozpustného vápenatého vo vode, a preto je účinný v aplikáciách citlivých na kyslík.
Používa sa na topenie a spracovanie železa a ocele. Je to založené na skutočnosti, že má topenie podobný bodu železa a tiež, že môže rozpustiť oxidy a kovy.
- V detektoroch rádioaktivity alebo nebezpečného žiarenia
Kaviareň2 Je to termoluminiscenčný materiál. To znamená, že dokáže absorbovať žiarenie v elektronoch svojej kryštalickej štruktúry a potom, keď sa zahrieva, aby sa uvoľnila vo forme svetla.
Toto emitované svetlo sa dá merať elektrickým signálom. Tento signál je úmerný množstvu žiarenia prijatého materiálom. Znamená, že čím väčšie je množstvo žiarenia, tým väčšie je množstvo svetla, ktoré sa bude emitovať neskôr, keď bude zahrievané.
Preto kaviareň2 Používa sa v So -Called Osobných dvojimetroch, ktoré používajú ľudia, ktorí sú vystavení nebezpečnému žiareniu a chcete vedieť, koľko žiarenia dostali v určitom časovom období.
- Iné použitia
- Používa sa ako katalyzátor v chemických reakciách dehydratácie a dehydrogenácie na syntézu organických zlúčenín.
- Používa sa v alkalických elektródach zvárania. Získava sa silnejšie zváranie ako v prípade kyslých elektród. Tieto elektródy sú užitočné pri výrobe lodí a vysokotlakových kontajnerov.
- Ako doplnok potravín v extrémne nízkom množstve (PPM alebo diely na milión).
 Zváranie muža. Elektródy s kávou fluoridom vápenatého2 Tvoria silnejšie zvary. William M. Tanier jr. [Verejná doména]. Zdroj: Wikimedia Commons.
Zváranie muža. Elektródy s kávou fluoridom vápenatého2 Tvoria silnejšie zvary. William M. Tanier jr. [Verejná doména]. Zdroj: Wikimedia Commons. Odkazy
- Pirmradian, m. a Hooshmand, T. (2019). Remineralizácia a antibakteriálne schopnosti zubných nanokompozitov založených na živicách. Syntéza a charakterizácia fluoridu vápenatého (CAF2). V aplikáciách nanokompozitných materiálov v stomatológii. Zotavené z vedeckých pracovníkov.com.
- Alebo.Siež. Lekárska knižnica. (2019). Fluorid vápnik. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Weman, K. (2012). Zváranie kovových oblúkov (MMA) s potiahnutými elektródami. V príručke Welding Processes Handbook (druhé vydanie). Zotavené z vedeckých pracovníkov.com.
- Hanning, m. a Hanning, C. (2013). Nanobiomateriály v preventívnom stomatológii. Nanosizovaný fluorid vápnik. V nanobiomateriáloch v klinickom stomatológii. Zotavené z vedeckých pracovníkov.com.
- Ropp, r.C. (2013). Skupina 17 (H, F, Cl, Br, I) Zlúčeniny alkalických zemín. Fluorid vápnik. V encyklopédii alkalických Zemech Zeme. Zotavené z vedeckých pracovníkov.com.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Valkovic, v. (2000). Merania rádioaktivity. V rádioaktivite v prostredí. TEMOLUMINESENTNÉ DETEKTORY (TLDS). Zotavené z vedeckých pracovníkov.com.
- « Štruktúra Nitruro de Boro (BN), vlastnosti, získanie, použitia
- Štruktúra oxidu kremíka (SIO2), vlastnosti, použitia, získanie »

