Oxid zlata (III) (Au2O3) Čo je, štruktúra, vlastnosti, používa
- 2769
- 258
- Gabriel Bahna
On Oxid zlata (III) Je to anorganická zlúčenina, ktorej chemický vzorec je au2Ani3. Teoreticky by sa jej povaha mohla očakávať mimo kovalentného typu. Prítomnosť určitého iónového charakteru v jeho pevnej látke však nemožno úplne vylúčiť; Alebo čo je to isté, predpokladajme neprítomnosť auta3+ vedľa aniónu alebo2-.
Môže sa zdať protirečivé, že zlato, ako šľachetný kov, môže oxidovať. Za normálnych podmienok sa zlaté kúsky nemôžu oxidovať kontaktom s kyslíkom atmosféry; Keď sú však ožarované ultrafialovým žiarením v prítomnosti ozónu, alebo3, Panorama je ďalšia.
Keby zlaté hviezdy prešli týmito podmienkami, stali by sa červenkastá hnedá farba, charakteristická pre Au2Ani3.
Iné metódy na získanie tohto oxidu by znamenali chemické ošetrenie týchto hviezd; Napríklad premena cesto zo zlata na jeho príslušný chlorid, AUCL3.
Potom do AUCL3, A zvyšok možných vytvorených soli zlata, pridá sa silné základné médium; A s tým sa získa hydratovaný alebo oxid hydroxidu, Au (OH)3. Nakoniec je táto zlúčenina tepelne dehydratovaná, aby sa získala Au2Ani3.
Štruktúra oxidu zlata (III)
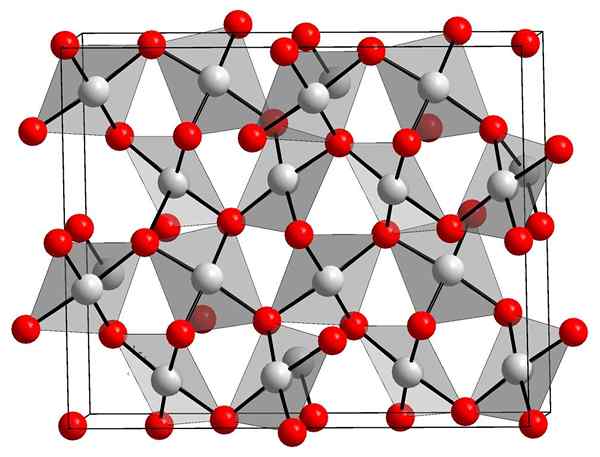
 Kryštalická štruktúra oxidu zlata. Orci, Wikimedia Commons.
Kryštalická štruktúra oxidu zlata. Orci, Wikimedia Commons. Horný obrázok zobrazuje kryštalickú štruktúru oxidu zlata (III). Ukázalo sa dispozícia atómov zlata a kyslíka v pevnej látke buď berúc do úvahy neutrálne atómy (kovalentná tuhá látka), alebo ióny (iónová tuhá látka). Zameniteľne, stačí eliminovať alebo umiestniť odkazy Au-O v každom prípade.
Podľa obrázka sa predpokladá, že kovalentný znak prevláda (čo by bolo logické). Z tohto dôvodu sú zobrazené atómy a odkazy reprezentované s guľami a tyčami. Biele gule zodpovedajú atómom zlata (AuIii-O) a červenkasté na atómy kyslíka.
Môže vám slúžiť: hydroxyapatitAk sa pozorne pozoruje, bude zrejmé, že existujú jednotky AUO4, ktoré sa viažu atómami kyslíka. Ďalším spôsobom, ako vizualizovať, by bolo zvážiť, že každý Au3+ je obklopený štyrmi resp2-; Samozrejme z iónového hľadiska.
Táto štruktúra je kryštalická, pretože atómy sú usporiadané dodržiavaním rovnakého vzoru s dlhým rozdielom. Jeho jednotná bunka teda zodpovedá rhombohedrálnemu kryštalickému systému (rovnako ako horný obrázok). Preto všetky Au2Ani3 Mohlo by sa to postaviť, ak by všetky tie sféry jednotkovej bunky boli distribuované vo vesmíre.
Elektronické aspekty
Zlato je prechodný kov a očakáva sa, že jeho 5D orbitály interagujú priamo s orbitálmi 2p atómu kyslíka. Toto prekrývanie svojich orbitálov musí teoreticky generovať vodičské kapely, čo by vytvorilo au2Ani3 V polovodičovej pevnej.
Preto skutočná štruktúra Au2Ani3 je ešte zložitejšie mať na pamäti.
Hydráty
Zlatý oxid si môže udržať molekuly vody vo vnútri svojich rhomboédikanických kryštálov, čo vedie k hydrátom. Keď sa takéto hydráty vytvoria, štruktúra sa stáva amorfnou, to znamená nepokojne.
Chemický vzorec pre takéto hydráty môže byť ktorýkoľvek z nasledujúcich možností, ktoré v skutočnosti nie sú hlboko objasnené: AU2Ani3∙ ZH2O (z = 1, 2, 3, atď.), Au (oh)3, alebo auXAnia(Oh)z.
Vzorec Au (OH)3 predstavuje zjednodušenie skutočného zloženia týchto hydrátov. Je to tak preto, že v rámci zlatého hydroxidu (III) vedci našli prítomnosť AU2Ani3; A preto stráca zmysel, aby ho považoval za izolovane ako s „jednoduchým“ hydroxidom prechodného kovu.
Môže vám slúžiť: rovnováha kvapaliny-vaporNa druhej strane tuhá látka s Au FormuleXAnia(Oh)z Dalo by sa očakávať amorfnú štruktúru; Pretože to závisí od koeficientov X, a a z, ktorých variácie by viedli k všetkým typom štruktúry, ktoré by ťažko mohli vykazovať kryštalický vzor.
Vlastnosti
Fyzický vzhľad
Je to červenkasto hnedá pevná látka.
Molekulárna hmotnosť
441,93 g/mol.
Hustota
11,34 g/ml.
Bod topenia
Topí sa a rozkladá sa pri 160 ° C. Chýba mu bod varu, takže tento oxid sa nikdy nevrie.
Stabilita
Au2Ani3 Je termodynamicky nestabilný, pretože, ako je uvedené na začiatku, zlato nemá tendenciu oxidovať v normálnych teplotných podmienkach. Takže sa ľahko zredukuje, aby sa stala ušľachtilým zlatom.
Čím vyššia je teplota, tým rýchlejšia bude táto reakcia, ktorá je známa ako tepelný rozklad. Au teda2Ani3 Pri 160 ° C sa rozkladá, aby sa vytvoril kovové zlato a uvoľnil molekulárny kyslík:
2 au2Ani3 => 4 Au + 3 o2
Veľmi podobná reakcia sa môže vyskytnúť s ostatnými zlúčeninami, ktoré uprednostňujú toto zníženie. Prečo redukcia? Pretože zlato získava elektróny, ktoré sa odstránil kyslík; Čo je to isté ako stratiť odkazy na kyslík.
Rozpustnosť
Je to nerozpustná pevná látka vo vode. Je však rozpustný v kyseline chlorovodíkovej a kyseliny dusičného v dôsledku tvorby chloridov a dusičnanov zlata.
Menovanie
Oxid zlata (III) je názov riadený nomenklatúrou akcie. Ďalšie spôsoby, ako to spomenúť, sú:
-Tradičná nomenklatúra: oxid aurický, pretože Valencia 3+ je najväčší pre zlato.
-Systematická nomenklatúra: Dioro Trioxid.
Žiadosti
Zafarbenie skla
Jedným z najvýznamnejších použití je poskytnutie červenkastej farby určitým materiálom, ako sú okuliare, okrem toho, že udeľujú určité vlastnosti spojené s atómami zlata.
Môže vám slúžiť: vodík Bromid (HBR)Syntéza operatív a fulminantného zlata
Ak sa pridá Au2Ani3 Do média, kde je rozpustné, a v prítomnosti kovov sa môže zrážať po pridaní silnej bázy, ktoré sa usilujú; ktoré tvoria Auo anióny4- V spoločnosti kovových katiónov.
Tiež Au2Ani3 reaguje s amoniakom za vzniku fulminantnej zlatej zlúčeniny, au2Ani3(NH3)4. Jeho meno vyplýva zo skutočnosti, že je veľmi výbušný.
Samostatne zostavená manipulácia s monokapami
Na zlato a jeho oxidu nie sú určité zlúčeniny adsorbované rovnakým spôsobom, ako je napríklad dial disulfur, RSSR. Ak dôjde k tejto adsorpcii, spontánne sa vytvorí väzba Au-S, kde atóm síry vykazuje a definuje chemické charakteristiky uvedeného povrchu v závislosti od funkčnej skupiny, s ktorou je prepojená.
RSSR nemožno adsorbovať nad au2Ani3, Ale o kovovom zlate. Preto, ak je povrch zlata a jeho stupeň oxidácie modifikované, ako aj veľkosť častíc alebo vrstiev Au2Ani3, Je možné navrhnúť heterogénny povrch.
Tento povrch au2Ani3-AUSR interaguje s oxidmi kovov určitých elektronických zariadení, čím sa vyvíja budúce múdrejšie povrchy.
Odkazy
- Oxidy zlata. Získané z: 911Metallurgist.com
- Shi, r. Asahi a C. Pečiatka. (2007). Vlastnosti oxidov zlata au2Ani3 Au2O: Výskum prvých princípov. Americká fyzická spoločnosť.
- « Chigualcan Čo je, charakteristiky, biotop, použitia, vlastnosti
- Hemidesmozómy Čo je, popis, štruktúra, funkcie »

