Štruktúra oxidu stroncia (SRO), vlastnosti, aplikácie
- 4038
- 1055
- JUDr. Rudolf Čapkovič
Vysvetlíme, aký oxid strontium, jeho chemická štruktúra, fyzikálne a chemické vlastnosti, aplikácie a riziká sú
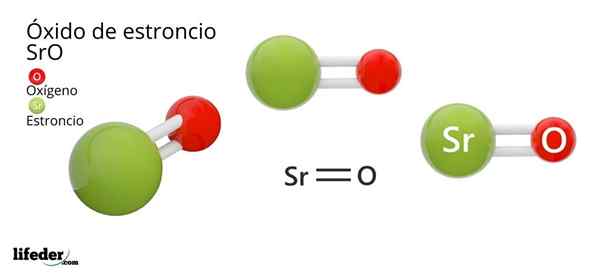
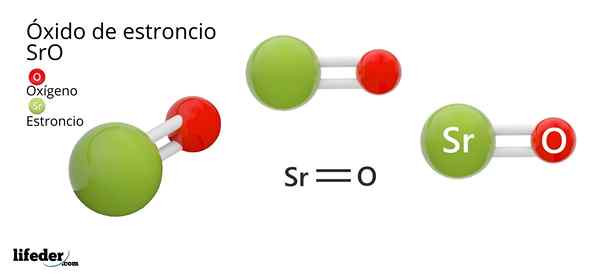
On Oxid stroncia, ktorého chemický vzorec je SRO (nie je zamieňaný so strontikom peroxidom, ktorý je SRO2), je produktom oxidačnej reakcie medzi týmto kovom a kyslíkom prítomným vo vzduchu pri teplote miestnosti: 2SR (S) + O2 (G) → 2Sro (s).
Kus stroncia horí v kontakte so vzduchom v dôsledku jeho vysokej reaktivity, a keďže má elektronickú konfiguráciu typu NS2, jeho dva valenčné elektróny sa ľahko poskytujú, najmä molekula diatomickej kyslíka.
Ak je povrchová plocha kovu rozšírená postrekovaním, kým nebude mať jemne rozdelený prášok, reakcia dôjde okamžite a dokonca horí intenzívnym červenkastým plameňom. Stroncium, kov, ktorý sa podieľa na tejto reakcii, je kov skupiny 2 periodickej tabuľky.
Táto skupina pozostáva z prvkov známych ako alkalický. Prvým z prvkov vedených skupinou je berylium, po ktorom nasleduje horčík, vápnik, stroncium, bária a nakoniec rádio. Tieto prvky majú kovovú povahu a ako som si na ne pamätať, výraz je možné použiť: „SR. Becambara ".
„MR“, na ktorý sa výraz vzťahuje, nie je nič iné ako kovové stroncium (SR), veľmi reaktívny chemický prvok, ktorý sa prirodzene nenachádza v jeho čistej podobe, ale v kombinácii s inými prvkami prostredia alebo jeho okolia, aby sa vznikli Jeho soli, nitridy a oxidy.
Z tohto dôvodu sú minerály a oxid stroncia zlúčeniny, v ktorých sa stroncium nachádza v prírode.
[TOC]
Fyzikálne a chemické vlastnosti oxidu stroncia
 Fyzický vzhľad oxidu stroncia
Fyzický vzhľad oxidu stroncia Oxid strontika je pevná biela, pórovitá a toaletná zlúčenina a v závislosti od jej fyzického spracovania sa na trhu nachádza ako jemný prach, ako sú kryštály alebo ako nanočastice.
Môže vám slúžiť: oxidyJeho molekulová hmotnosť je 103 619 g/mol a má vysoký index lomu. Má fúzne body (2531 ° C) a varenie (3200 ° C), čo sa premieta do silných interakcií spojenia medzi strontikom a kyslíkom. Tento vysoký bod topenia z neho robí tepelne stabilný materiál.
Základný oxid
Je to veľmi základný oxid; To znamená, že reaguje pri teplote miestnosti s vodou za vzniku hydroxidu stroncia (SR (OH) 2):
SRO (S) + H2O (L) → SR (OH) 2
Rozpustnosť
Reaguje tiež alebo si zachováva vlhkosť, základnú charakteristiku hygroskopických zlúčenín. Preto má oxid strontika vysokú reaktivitu s vodou.
V iných rozpúšťadlách - napríklad alkoholy, ako je etanol farmácie alebo metanol - sú mierne rozpustné; Zatiaľ čo v rozpúšťadlách, ako je acetón, éter alebo dichlórmetán, je nerozpustný.
Prečo je to takto? Pretože kovové oxidy -a ešte viac tie, ktoré sa tvoria z alkalinoterróznych kovov -sú polárne zlúčeniny, a preto interagujú do lepšieho stupňa s polárnymi rozpúšťadlami.
Nielenže môže reagovať s vodou, ale aj s oxidom uhličitého, ktorý produkuje uhličitan strontium:
SRO (S) + CO2 (G) → SRCO3 (S)
Reaguje s kyselinami - napríklad zriedenou kyselinou fosforečnou - za vzniku soli so soľou a vodou:
3SRO (S) + 2 H3PO4 (DIL) → SR3 (PO4) 2 (s) + 3H2O (G)
Tieto reakcie sú exotermické, a preto je vyrobená voda odparovaná vysokými teplotami.
Chemická štruktúra
Chemická štruktúra zlúčeniny vysvetľuje, aké sú jej atómy vo vesmíre. V prípade oxidu stroncia predstavuje kryštalickú štruktúru typu drahokamu, rovnakú stolovú soľ alebo chlorid sodný (NaCl).
Môže vám slúžiť: hydrogenuhličitan vápenatýNa rozdiel od NaCl, monovalentná soľ -to je s katiónmi a aniónmi veľkosti zaťaženia (+1 pre NA a -1 pre Cl) -SRO je dvojmocná, s 2+ zaťažením pre SR a od -2 pre -2 O (O2-, oxid anión).
V tejto štruktúre je každý O2- (červený) ión obklopený šiestimi ďalšími objemnými oxidmi, pričom vo výsledných oktaedrických medzerách je hostiteľom iónov SR2+ (zelená farba), menšie. Toto balenie alebo usporiadanie je známe ako kubické jednotné bunky zamerané na tváre (CCC).
Typ odkazu
Chemický vzorec oxidu stroncia je SRO, ale úplne nevysvetľuje chemickú štruktúru alebo existujúci typ spojenia.
V predchádzajúcej časti sa uvádza, že predstavuje štruktúru soli Gema; to znamená, veľmi bežná kryštalická štruktúra pre mnoho solí.
Preto je typ prepojenia prevažne iónový, čo by objasnilo, prečo má tento oxid vysoké body fúzie a varu.
Pretože spojenie je iónové, sú to elektrostatické interakcie, ktoré udržujú atómy stroncia a kyslíka pohromade: SR2+ O2-.
Keby bola táto väzba kovalentná, zlúčenina by mohla byť reprezentovaná s odkazmi v jeho Lewisovej štruktúre (vynechanie nezdieľaných kyslíkových elektrónov).
Žiadosti
Fyzikálne vlastnosti zlúčeniny sú nevyhnutné na predpovedanie, aké by boli ich potenciálne aplikácie v priemysle; Preto sú makro odrazom jeho chemických vlastností.
Náhrada za vedenie
Oxid stroncia, vďaka svojej vysokej tepelnej stabilite, nájde veľa aplikácií v keramickom, sklenenom a optickom priemysle.
Jeho použitie v týchto odvetviach je hlavne určené na nahradenie olova a byť prísadou, ktorá poskytuje lepšie farby a viskozity suroviny výrobkov.
Môže vám slúžiť: Prenajmite si halogenuros: vlastnosti, získanie, príkladyKtoré výrobky? Zoznam by nemal koniec, pretože v žiadnom z nich má sklo, smalting, keramiku alebo kryštály v jednom zo svojich kusov, môže byť užitočný oxid strontika.
Letecký priemysel
Pretože je to veľmi pórovitá látka, môže prepletiť menšie častice, a tak poskytovať celý rad možností pri formulovaní materiálov, ako svetlo, ktoré sa má zvážiť leteckým priemyslom.
Katalyzátor
Rovnaká pórovitosť vám umožňuje mať potenciálne využitie ako katalyzátor (urýchľovač chemických reakcií) a ako výmenník tepla.
Elektronické účely
Oxid strontika tiež slúži ako zdroj výroby čistého Strbanu na elektronické účely vďaka schopnosti tohto kovu absorbovať X -Rays; A na priemyselnú prípravu jeho hydroxidu, SR (OH) 2 a jeho peroxidu, SRO2.
Zdravotné riziká
Je to korozívna zlúčenina, takže môže spôsobiť popáleniny jednoduchým fyzickým kontaktom kdekoľvek v tele. Je veľmi citlivý na vlhkosť a musí sa skladovať v suchých a studených priestoroch.
Salty produkt reakcie tohto oxidu s rôznymi kyselinami sa správajú v tele, ako aj ako vápnikové soli a sú skladované alebo vylúčené podobnými mechanizmami.
V tom čase samo osebe nepredstavuje väčšie zdravotné riziká.
Odkazy
- Americké prvky. (1998-2018). Americké prvky. Zotavené z americalmentov.com
- Triasť a Atkins. (2008). Anorganická chémia. V štruktúrach jednoduchých tuhých látok (štvrté vydanie., p. 84). MC Graw Hill.
- ATSDR. Získané z ASDR: ATSDR.CDC.Vláda
- Clark, J. (2009). Chemguide. Obnovený z chemguide.co.Uk
- Tiwary, r., Narayan, s., & Pandey, alebo. (2007). Príprava oxidu z ulice z Celestitu: prehľad. Materials Science, 201-211.

