Vlastnosti oxidu chlóru (III), štruktúra, použitie
- 4546
- 393
- Alfréd Blaho
On Oxid chlóru (III) Je to anorganická zlúčenina, ktorej chemický vzorec je CL2Ani3. Zodpovedá anhydridu kyseliny chlór, HCLO2. Je to tmavo hnedá pevná látka, vysoko výbušná aj pri teplotách pod 0 ° C a zle charakterizovaná. Preto je predmetom záujmu o počítačové štúdie.
Chemicky je to kovalentný oxid, takže existujú väzby CL-O a diskrétna molekula CL2Ani3 (nižší obrázok). Táto molekula môže dobre tvoriť dehydratáciu HCLO2, alebo jeho podrobením nízkym teplotám. Detail je v tom, že rozkladá produkciu CL2, Ani2, alebo iné termodynamicky stabilnejšie oxidy chlóru.
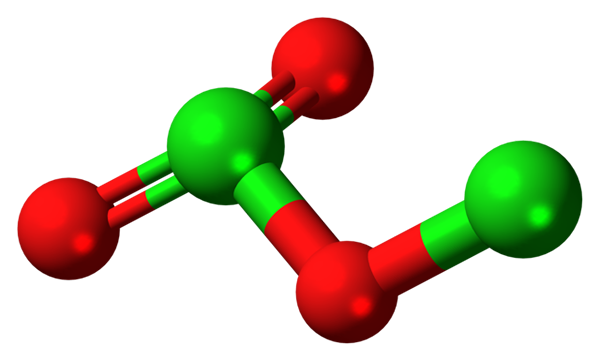
 Molekula dikloroxidu. Zdroj: Jynto [CC0].
Molekula dikloroxidu. Zdroj: Jynto [CC0]. Pretože dlhopisy CL-O sú malé polárne, e-mail CL2Ani3 Má malý dipólový moment; Preto sa nerozpúšťa vo vode ani interaguje s inými polárnymi rozpúšťadlami. Jeho nestabilita je taká, že nie je známa komerčným alebo potenciálnym použitím (alebo ako výbušná jeho uplatniteľnosť by bola životaschopná).
Hlavným dôvodom jej nestability môže byť elektronické charakteristiky údajného CL3+ (za predpokladu čisto iónového charakteru). V skutočnosti sú jeho oxidácia +1 a +5 najstabilnejšie, keď chlór tvorí zlúčeniny s kyslíkom.
[TOC]
Vlastnosti
Pretože jeho charakterizácia je slabá a nie je zdokumentovaná, nie je čo povedať o jeho vlastnostiach okrem nasledujúcich bodov:
-Má molekulárnu hmotnosť 118 903.
-Je to pevná tmavohnedá; Aj keď môžete sublimalizovať plynový chlór, hovoríte žltkasté zelené pary.
-Chýba mu vriaci a fúzny bod, pretože pri 0 ° C exploduje (a tiež pri chladnejších teplotách).
Môže vám slúžiť: Dihydroxyacetón fosfát (DHAP): Charakteristiky a aplikácie-Jeho rozpustnosť vo vode sa odhaduje okolo 3,42 g/100 ml, čo dokazuje, že ide o kovalentnú molekulu s nízkou polaritou.
-Reaguje s vodou (malá, ktorá sa rozpúšťa), aby sa stala HCLO2:
Cl2Ani3 + H2Alebo 2hclo2
Štruktúra oxidu chlóru (III)
Na obrázku bola zobrazená molekulárna štruktúra Cl2Ani3 S sférou a tyčovým modelom. Aj keď sa to nezdá voľným okom, tiché dôsledky ich priestorových väzieb a usporiadaní sú komplikovanejšie, ako sa objavujú. Táto štruktúra zodpovedá jednému z mnohých možných izomérov pre túto zlúčeninu.
Červené gule zodpovedajú atómom kyslíka a zelené atómy chlóru. Chlór vľavo predstavuje trigonálnu geometriu pyramídy s niekoľkými voľnými elektrónmi; Takže sa dá predpokladať, že vaša hybridizácia musí byť SP3. Atóm kyslíka pôsobí ako most medzi dvoma chloros, cl-o-cl.
Izoméry
Aké sú ostatné izoméry? Teoreticky sa vypočíta deväť, z ktorých štyri sú najstabilnejšie (vrátane obrázka). Ostatné tri by mali štruktúry ako:
-Clclo3. Veľmi podobné tomu vysvetlenému, ale s odkazom CL-Cl.
-Clooocl (1). V tomto izoméri je most s tromi kyslíkom, ktorý oddeľuje dva atómy chlóru (nezabudnite na uhlovú geometriu H2Alebo vizualizovať).
-Clooocl (2). Rovnaký okysličený most je tiež prítomný v tomto izoméri, s výnimkou dvoch atómov chlóru sú zatienené vo vesmíre; jeden pred druhým, zatiaľ čo v predchádzajúcom izoméri sú vzdialené.
Môže vám slúžiť: AlquinosMenovanie
Jeho názov, oxid chlóru (III), zodpovedá prideleným podľa nomenklatúry zásob. Tu sa predpokladá, že chlór má oxidačný stav +3; To však neznamená, že cl katión3+ môže byť prítomný. Je to molekula, nie iónová sieť.
Iné meno, podľa ktorého je známy CL2Ani3 Je to dikloro oxid podľa systematickej nomenklatúry.
A finále. Toto meno je spôsobené skutočnosťou, že, ako už bolo vysvetlené, CL2Ani3 Vyskytuje sa, keď HCLO2 Kondenzuje vodu zalievanie.
Žiadosti
Pretože je to oxid chlóru, najprostrednejšie použitie, ktoré by sa dalo myslieť na CL2Ani3 Je to ako oxidačné činidlo, ktoré je schopné neutralizovať organické nečistoty a mikróby. Je však veľmi nestabilný, okrem výbušniny, takže na tento účel sa považuje za užitočný.
Určite neexistujú žiadne informácie, ani to, ako by sa CL správal2Ani3 pri obrovských tlakoch (ak v tomto procese nevybuchne). Za normálnych podmienok sa zdá, že nie je ničím iným ako relatívne stabilným a diferencovateľným sprostredkovateľom medzi inými stabilnejšími oxidmi chlóru.
Výpočtovo sa však podlieha štúdiu na určenie mechanizmov voľnými radikálmi, ktoré zahŕňajú niekoľko druhov chlóru a kyslíka.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2019). Trioxid. Zdroj: In.Wikipedia.orgán
- Daj mu l. Hrebeň. (2011). Príručka anorganických zlúčenín. (Druhé vydanie). CRC Press Taylor & Francis Group.
- Richard C. Štrbina. (2013). Encyklopédia alkalických zlúčenín Zeme. Elsevier.
- Kim K. H., Han a.Klimatizovať., a čítať a. Siež. (1999). Základné nastavené účinky na stabilitu izomérov CL2O3 pomocou metód B3P86 a B3LYP funkčnej teórie hustoty. Časopis molekulárnej štruktúry Theochem 460 (1-3): 19-25.
- « Štruktúra, vlastnosti, použitia hydroxidu železa
- Štruktúra tetrodotoxínu, charakteristiky, použitia, efekty »

