Voltamperometria
- 4131
- 735
- Ing. Ervín Petruška
 Voltamperometria je elektrochemická metóda, ktorá meria prúd elektródy
Voltamperometria je elektrochemická metóda, ktorá meria prúd elektródy Čo je voltamperometria?
Ten voltamperometria Je to elektroanalytická technika, ktorá určuje informácie z chemických alebo analytových druhov z elektrických prúdov generovaných variáciou aplikovaného potenciálu. To znamená, že potenciálne e (v) aplikované a čas (t) sú nezávislé premenné; Zatiaľ čo prúd (a), závislá premenná.
Chemické druhy by mali byť zvyčajne elektroaktívne. To znamená, že musí stratiť (oxidovať) alebo vyhrať (redukovať) elektróny. Aby sa iniciovala reakcia, musí pracovná elektróda poskytnúť potrebnú potenciálnu teoreticky pomocou Nernstovej rovnice.
Táto metóda sa široko používa v anorganických, biochémii a fyzikálnej chémii, najmä na analýzu oxidačných, redukčných alebo adsorpčných procesov.
Ako funguje voltamperometria?
Voltamperometria bola vyvinutá vďaka vynálezu Nobelovej chémie Nobelovej chémie z roku 1922 Jaroslav Heyrovsky (1890-1967). V ňom je elektróda ortuťovej kvapky (EGM) neustále obnovovaná a polarizovaná.
Analytické nedostatky tejto metódy v tom čase boli vyriešené s použitím a návrhom iných mikroelektród. Tieto sa veľmi líšia od materiálu, od uhlia, ušľachtilých kovov, diamantov a polymérov, dokonca aj vo svojom dizajne, diskoch, valcoch, listoch; A navyše, spôsobom, akým interagujú s roztokom: stacionárne alebo rotačné.
Všetky tieto podrobnosti sú určené1). Je to úmerné koncentrácii analytu a polovici moci e (e (e1/2) dosiahnuť polovicu tohto prúdu (i1/2) je charakteristický pre tento druh.
Takže určenie hodnôt E1/2 V krivke, kde sa prúd získaný s variáciou E grafom nazýva voltamegram, Je možné identifikovať prítomnosť analytu. To znamená, že každý analyt, za podmienok experimentu, bude mať svoju vlastnú hodnotu E1/2.
Môže vám slúžiť: bod rovnocennostiVoltamperometrická vlna
V voltamperometrii pracujeme s mnohými grafmi. Prvým je krivka e vs. T, čo vám umožňuje monitorovať potenciálne rozdiely aplikované ako funkcia času.
Ale zároveň, elektrický obvod zaznamenáva hodnoty C vytvorené analytom pri strate alebo získaní elektrónov v blízkosti elektródy.
Pretože elektróda je polarizovaná, z lona roztoku je možné šíriť menej analytu. Napríklad, ak má elektróda kladný náboj, druh x- Priťahuje ho a povedie ho kvôli obyčajnej elektrostatickej príťažlivosti.
Ale x- nie je sám: vo vašom prostredí sú prítomné ďalšie ióny. Niektoré katióny m+ Môžu brániť svojej ceste k elektróde ich lokalizáciou v „zhlukoch“ pozitívnych nábojov; A tiež anióny n- Môžu byť ukradnuté okolo elektródy a zabrániť x- Dostanem sa k nemu.
Súčet týchto fyzikálnych javov spôsobuje stratu prúdu, a to sa pozoruje v C vs. E a jeho forma podobná forme S, nazývanej forma Sigmoid. Táto krivka je známa ako voltamperometrická vlna.
Prístrojové vybavenie
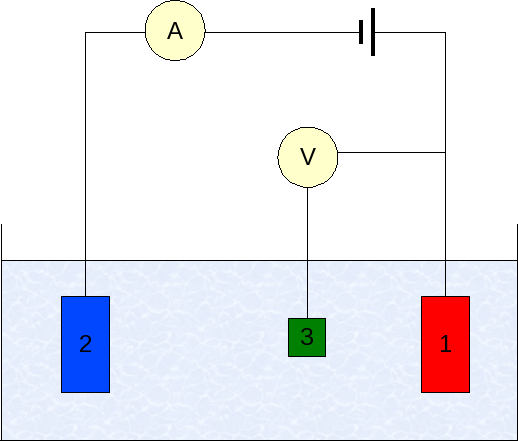 Elektródy v voltamperometrii. Zdroj: Wikimedia Commons
Elektródy v voltamperometrii. Zdroj: Wikimedia Commons Príspevok voltamperometrie sa líši podľa analytu, rozpúšťadla, typu elektród a aplikácie. Prevažná väčšina z nich je však založená na systéme zloženom z troch elektród: jednej z práce (1), pomocného (2) a referencie (3).
Použitá hlavná referenčná elektróda je elektróda Calomenanos (ECS). To spolu s pracovnou elektródou umožňuje stanoviť potenciálny rozdiel AE, pretože potenciál referenčnej elektródy zostáva počas meraní konštantný.
Môže vám slúžiť: selén: História, vlastnosti, štruktúra, získanie, použitieNa druhej strane, pomocná elektróda je zodpovedná za riadenie záťaže, ktoré prechádza do pracovnej elektródy, aby sa udržala v rámci prijateľných hodnôt. Nezávislá premenná, rozdiel s použitím potenciálu, je miera získaná súčtom potenciálov pracovných elektród a referencie.
Typy voltamperometrie
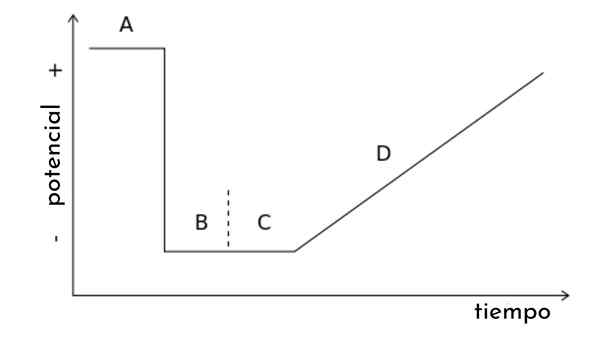
Na obrázku článku je zobrazený graf. T, nazývaná tiež potenciálna vlna pre lineárnu skenovú voltamperometriu.
Je zrejmé, že postupom času sa zvyšuje potenciál. Toto zametanie zase generuje krivku odpovede alebo voltamperaogram C vs. E, ktorého forma bude sigmoid. Bodí sa tam, kde bez ohľadu na to, ako sa zvyšuje, nedôjde k zvýšeniu prúdu.
Z tohto grafu je možné odvodiť ďalšie typy voltamperometrie, čím sa modifikuje potenciálna vlna. t náhlymi potenciálnymi impulzmi podľa určitých vzorov. Každý vzorec je spojený s typom voltamperometrie a zahŕňa svoju vlastnú experimentálnu teóriu a podmienky.
Pulzná voltaperometria
V tomto type voltamperometrie môžete analyzovať zmesi dvoch alebo viacerých analytov, ktorých e e1/2 sú veľmi blízko k sebe.
Analyt s E teda1/2 z 0.04V je možné identifikovať v spoločnosti inej s E1/2 z 0.05V. Zatiaľ čo v lineárnom skenovom voltamperometrii musí byť rozdiel väčší ako 0.2V.
Preto existuje väčšia citlivosť a nižšie limity detekcie; to znamená, že analyty sa dajú určiť vo veľmi nízkych koncentráciách.
Potenciálne vlny môžu mať podobné vzory ako schody, naklonené schody a trojuholníky. Ten zodpovedá cyklickej voltamperometrie (CV).
Môže vám slúžiť: obmedzenie a nadmerné činidloV CV potenciál a aplikujte v istom zmysle, pozitívny alebo negatívny a potom, v určitej hodnote E v čase, rovnaký potenciál, ale v opačnom zmysle sa znovu aplikuje. Pri štúdiu generovaných voltampov, maximá odhaľujú prítomnosť sprostredkovateľov v chemickej reakcii.
Voltamperometria redisolúcie
To môže byť anodický alebo katódový typ. Skladá sa z elektrodepozície analytu na ortuťovej elektróde. Ak je analyt kovovým iónom (napríklad CD2+) sa vytvorí amalgám; A ak je to anión (ako Moo42-), nerozpustná ortuťová soľ.
Potom sa použijú potenciálne impulzy na stanovenie koncentrácie a identity druhov elektrodepos. Amalgám je teda redisuelve, rovnako ako ortuťové soli.
Aplikácie voltaperometrie
- Na stanovenie koncentrácie kovov rozpustených tekutinou sa používa anodická redisolútna voltamperometria.
- Umožňuje študovať kinetiku redoxných alebo adsorpčných procesov, najmä ak sú elektródy modifikované na detekciu špecifického analytu.
- Jeho teoretická základňa slúžila na výrobu biosenzorov. S nimi je možné určiť prítomnosť a koncentráciu biologických molekúl, bielkovín, tukov, cukrov atď.
- Nakoniec zistí účasť sprostredkovateľov na reakčných mechanizmoch.
Odkazy
- González m. (2010). Voltamperometria. Získané z: chémie.LAGUIA2000.com
- Chémia a veda (2011). Voltamperometria. Zdroj: Thequimica andlacicia.Blog.com
- Quiroga a. (2017). Cyklická voltametria. Získané z: Chem.Librettexts.orgán
- Samuel p. Kouves (s.F.). Voltametrické techniky. [PDF]. Univerzita. Získané z: hnedej.Edu
- Deň. & Underwood a. Kvantitatívna analytická chémia (Piate ED.). Pearson Prentice Hall.

