Tritio
- 4454
- 693
- Mgr. Pravoslav Mokroš
Čo je trícium?
On Tritio Je to meno, ktoré bolo udelené jednému z izotopov chemického prvku vodíka, ktorého symbol je zvyčajne T alebo 3H, hoci sa tiež nazýva vodík-3. Toto sa široko používa vo veľkom počte aplikácií, najmä v jadrovom poli.
V 30. rokoch minulého storočia tento izotop pochádza prvýkrát na základe bombardovania s vysoko energiou (nazývanými deuterónmi) iného izotopu toho istého prvku nazývaného Deutérium, vďaka vedcom P. Harteck, m. L. Oliphant a E. Rutherford.
Títo vedci neboli úspešní v izolácii trícia napriek ich esejom, ktoré vykazovali konkrétne výsledky v rukách Cornoga a Álvarezu, keď objavili rádioaktívne vlastnosti tejto látky.
Na tejto planéte je produkcia trícia mimoriadne zriedkavá a pochádza iba z takých malých rozmerov, že stopy sa posudzujú prostredníctvom atmosférických interakcií s kozmickým žiarením.
Tritio štruktúra
Keď hovoríme o štruktúre tríciu, prvá vec, ktorú by sa malo všimnúť.
Tento izotop má fyzikálne a chemické vlastnosti, ktoré ho odlišujú od ostatných izotopových druhov od vodíka, napriek jeho štrukturálnym podobnostiam.
Okrem atómovej hmotnosti alebo hmotnosti okolo 3 g, táto zjavná látka rádioaktivity, ktorej kinetické charakteristiky vykazujú polovicu života približne 12,3 roka.

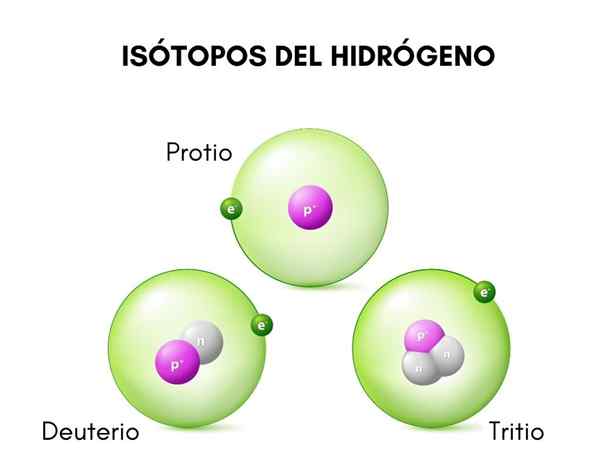
Na hornom obrázku sa porovnávajú štruktúry troch známych izotopov vodíka, nazývané protio (druh väčšieho množstva), deutérium a trícium.
Môže vám slúžiť: Plavba pre tégliku: Charakteristiky, funkcie, použite príkladyŠtrukturálne charakteristiky trícia mu umožňujú koexistovať s vodíkom a deutériom vo vode, ktorá pochádza z prírody, ktorej produkcia je pravdepodobne spôsobená interakciou medzi kozmickým žiarením a dusíkom atmosférického pôvodu.
V tomto zmysle je táto látka prezentovaná vo vode prírodného pôvodu v podiele 10-18 vo vzťahu k bežnému vodíku; to znamená, veľmi malé množstvo, ktoré možno rozpoznať iba ako stopy.
Niektoré údaje o tríciu
Bolo skúmaných a použitých niekoľko spôsobov výroby Tritio kvôli ich vysokému vedeckému záujmu o rádioaktívne a energetické využívanie vlastností, ktoré predstavuje.
Týmto spôsobom nasledujúca rovnica ukazuje všeobecnú reakciu, ktorou sa tento izotop vyskytuje, od bombardovania atómov deutérium s vysokovýkonnými deuterónmi:
D + D → T + H
Môže sa tiež vykonávať ako exotermická alebo endotermická reakcia prostredníctvom procesu nazývanej neutrónová aktivácia určitých prvkov (ako je lítium alebo bór) a v závislosti od liečenia prvku.
Okrem týchto metód môže Tritio zriedkavé z jadrového štiepenia, ktoré pozostáva z delenia jadra atómu považovaného za ťažké (v tomto prípade izotopy uránu alebo plutónu), aby sa získali dve alebo viac jadier menšej veľkosti, čo produkuje obrovské množstvá energia.
V tomto prípade je získanie Tritio dané ako kolaterál alebo produkt produktu -nie je to účel tohto mechanizmu.
S výnimkou procesu, ktorý bol predtým opísaný, sa všetky tieto výrobné procesy týchto izotopových druhov vykonávajú v jadrových reaktoroch, v ktorých sú podmienky každej reakcie kontrolované.
Môže vám slúžiť: Pyrex GlassTritio vlastnosti
- Vytvára obrovské množstvo energie, keď pochádza z deutéria.
- Predstavuje vlastnosti rádioaktivity, ktoré naďalej vzbudzujú vedecký záujem o výskum jadrovej fúzie.
- Tento izotop je znázornený v jeho molekulárnej forme ako t2 ani 3H2, ktorého molekulová hmotnosť je okolo 6 g.
- Podobne ako v prípade protio a deutéria, táto látka má ťažkosti s obmedzením.
- Keď je tento druh kombinovaný s kyslíkom, oxid vzniká (predstavuje sa ako T2O) To je v kvapalnej fáze a je bežne známa ako voda Superpesada.
- Je schopný zažiť fúziu s inými svetelnými druhmi ľahšie ako v prípade bežného vodíka.
- Predstavuje nebezpečenstvo pre životné prostredie, ak sa používa masívne, najmä vo fúznych procesoch reakcií.
- Môže sa tvoriť kyslíkom Ďalšia látka známa ako polo -perpetrovaná voda (reprezentovaná ako HTO), ktorá je tiež rádioaktívna.
- Považuje sa za nízkoenergetický generátor častíc, známy ako beta žiarenie.
- Keď boli predložené prípady rozdrvenej spotreby vody, zistilo sa, že jeho polovičný život v tele sa udržiava v rozmedzí 2,4 až 18 dní, následne sa vylučuje.
Použitie/aplikácie
Medzi aplikáciami tríciu patria procesy súvisiace s reakciami jadrového typu. Potom je uvedený zoznam s najdôležitejšími použitiami:
- V oblasti rádioluminiscencie sa trícium používa na výrobu nástrojov, ktoré umožňujú osvetlenie, najmä nočné, v rôznych zariadeniach komerčného použitia, ako sú hodinky, nože, strelné zbrane, prostredníctvom samostatnej farby.
Môže vám slúžiť: oxid cerio (IV): Štruktúra, vlastnosti, použitia- V oblasti jadrovej chémie sa reakcie tohto typu používajú ako zdroj energie pri výrobe jadrových a termonukleárnych zbraní, okrem toho, že sa používajú v kombinácii s deutériom pre procesy jadrovej fúzie pod kontrolou.
- V oblasti analytickej chémie sa tento izotop môže použiť v procese rádioaktívneho označovania, kde je Tritio umiestnené do konkrétneho druhu alebo molekuly a môžete sledovať štúdie, ktoré chcete precvičiť.
- V prípade biologického prostredia sa Tricium používa ako prechodný indikátor v oceánskych procesoch, čo umožňuje skúmanie vývoja oceánov na Zemi vo fyzických, chemických a dokonca biologických sférach.
- Tento druh sa okrem iného použil na výrobu atómovej batérie s cieľom vyrábať elektrinu.

