Deutérium
- 2047
- 631
- Tomáš Mydlo
Čo je deutérium?
On deutérium Je to jeden z izotopových druhov vodíka, ktorý je znázornený ako D alebo 2H. Okrem toho bol uvedený názov ťažkého vodíka, pretože jeho hmotnosť je dvojnásobná hmotnosť protónu. Izotop je druh, ktorý pochádza z toho istého chemického prvku, ale ktorého hmotnostné číslo sa líši od tohto.
Toto rozlíšenie je spôsobené rozdielom v počte neutrónov, ktoré má. Deutérium sa považuje za stabilný izotop a možno sa nachádzať v zlúčeninách tvorených vodíkom prírodného pôvodu, hoci v pomerne malom podiele (menej ako 0,02 %).
Vzhľadom na svoje vlastnosti, veľmi podobné vlastnostiam bežného vodíka, môže nahradiť vodík vo všetkých reakciách, na ktorých sa zúčastňuje, a stáva sa ekvivalentnými látkami.
Z tohto a ďalších dôvodov má tento izotop veľa aplikácií v rôznych oblastiach vedy a stáva sa jednou z najdôležitejších.
Deutérium
Štruktúra deutéria je tvorená hlavne jadrom, ktorý má protón a neutrón, s atómovou hmotnosťou alebo hmotnosťou približne 2 014 g.
Podobne tento izotop dlhuje svoj objav Haroldovi C. Urey, chemik zo Spojených štátov a jeho spolupracovníci Ferdinand Brickwedde a George Murphy, v roku 1931.

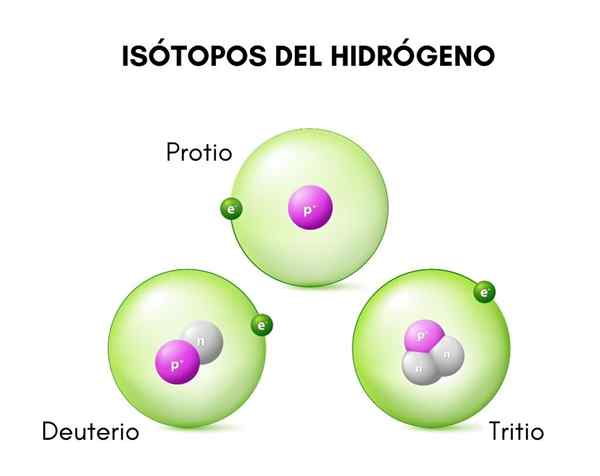
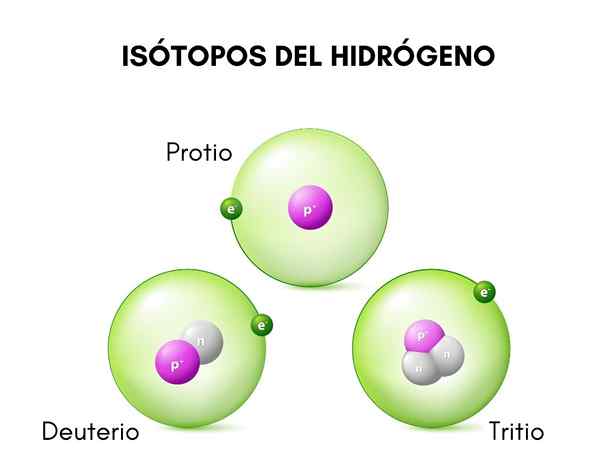
Na hornom obrázku môžete vidieť porovnanie štruktúr izotopov vodíka, ktoré existuje v protio forme (jeho najhojnejší izotop), deutérium a trícium, usporiadané zľava doprava.
Príprava deutéria v jeho čistom stave sa uskutočnila po prvýkrát v roku 1933, ale od 50. rokov 20. storočia sa použila látka solídnej fázy a ktorá preukázala stabilitu, nazývanú lítium deuterid (LID), na nahradenie Deuterium a TITIum in veľké množstvo chemických reakcií.
Môže vám slúžiť: oxid chlóru (iii): Vlastnosti, štruktúra, použitieV tomto zmysle sa študovalo množstvo tohto izotopu a zistilo sa, že jej podiel vo vode sa môže mierne meniť, v závislosti od zdroja, od ktorého sa vzorka odoberie.
Okrem toho prostredníctvom spektroskopických štúdií bola stanovená existencia tohto izotopu na iných planétach tejto galaxie.
Niektoré údaje o deutériu
Základný rozdiel medzi izotopmi vodíka (ktoré sú jediné, ktoré boli pomenované rôznymi spôsobmi) leží v ich štruktúre, pretože množstvo protónov a neutrónov druhu udeľuje jeho chemické vlastnosti.
Na druhej strane, existujúce deutérium vo vnútri hviezdnych telies je eliminované rýchlejšou rýchlosťou, ako je pôvodom.
Okrem toho sa predpokladá, že iné javy prírody tvoria iba veľmi malé množstvo, takže jej výroba dnes naďalej vytvára záujem.
Podobne séria vyšetrovaní odhalila, že veľká väčšina atómov, ktoré tvorili tento druh, vznikla vo veľkom tresku; To je dôvod, prečo je varovaná jeho prítomnosť na veľkých planétach, ako je Jupiter.
Pretože najbežnejším spôsobom dosiahnutia tohto druhu v prírode je, keď sa kombinuje s vodíkom vo forme protio, záujem vedeckej komunity sa stále prebúdza vzťahom medzi podielom oboch druhov v rôznych oblastiach vied, ako je napríklad ako astronómia alebo počasie.
Môže vám slúžiť: Renio: Discovery, vlastnosti, štruktúra, použitieDeutérium
- Je to izotop, ktorý nemá rádioaktívne charakteristiky; to znamená, že je svojou povahou dosť stabilný.
- Môže sa použiť na nahradenie atómu vodíka v chemických reakciách.
- Tento druh prejavuje v biochemických reakciách iné správanie ako obyčajný vodík.
- Keď sa tieto dva atómy vodíka nahradia vo vode, získa sa d2Alebo získanie názvu ťažkej vody.
- Vodík prítomný v oceáne, ktorý je vo forme deutéria, existuje v podiele 0,016 % vo vzťahu k protio.
- V hviezdach má tento izotop tendenciu rýchlo fúkať, aby viedol k héliu.
- D2Alebo predstavuje toxický druh, hoci jeho chemické vlastnosti sú veľmi podobné vlastnostiam H2
- Ak sú atómy deutéria podrobené procesu jadrovej fúzie pri vysokých teplotách, získanie odlúčenia veľkého množstva energie.
- Fyzikálne vlastnosti, ako je bod varu, hustota, teplo odparovania, trojitý bod, majú v molekulách deutéria hlavné veľkosti (d2), že vo vodíku (h2).
- Najbežnejším spôsobom, akým sa nachádza, je spojený s atómom vodíka, čo spôsobuje deuterid vodíka (HD).
Použitie/aplikácie
Vďaka svojim vlastnostiam sa deutérium používa v rôznych aplikáciách, v ktorých je zapojený vodík. Niektoré z týchto použití sú opísané nižšie:
- V oblasti biochémie sa používa pri izotopovom označení, ktoré pozostáva z „označenia“ vzorky s izotopom vybraným na jeho sledovanie priechodom cez daný systém.
Môže vám slúžiť: silná kyselina- V jadrových reaktoroch, ktoré vykonávajú fúzne reakcie, sa používa na zníženie rýchlosti, s akou sa neutróny pohybujú bez ich vysokej absorpcie, ktorú predstavuje obyčajný vodík.
- V oblasti jadrovej magnetickej rezonancie (NMR) sa rozpúšťadlá založené na deutériu používajú na získanie vzoriek tohto typu spektroskopie bez prítomnosti interferencie, ktoré sa produkujú pomocou hydrogenovaných rozpúšťadiel.
- V oblasti biológie sa makromolekuly študujú pomocou neutrónových disperzných techník, kde sa vzorky poskytnuté s deutériom používajú na významné zníženie hluku v týchto kontrastných vlastnostiach.
- Vo farmakológii sa náhrada vodíka používa deutériom s kinetickým izotopovým účinkom, ktorý sa vytvára a umožňuje týmto liekom mať dlhšiu polovicu života.