Trietalamínová štruktúra, vlastnosti, použitia a riziká

- 1603
- 389
- Tomáš Mydlo
Ten triedíny Je to organická zlúčenina, presnejšie alifatický amín, ktorého chemický vzorec je n (CH2Chvály3)3 alebo sieť3. Rovnako ako iné tekuté amíny, predstavuje zápach podobnú amoniaku zmiešaným s rybami; Jeho výpary robia únavnú a nebezpečnú manipuláciu s touto látkou bez vhodného extraktora alebo oblečenia.
Okrem príslušných vzorcov je zvyčajne skrátená k tejto zlúčenine ako ASD; Môže to však spôsobiť zámenu s inými amínmi, ako je tritanolamín, N (Ethoh)3, alebo tetraetilamónia, kvartérna amina, sieť4+.
 Triedtylamínová kostra. Zdroj: Zmesi [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/]]
Triedtylamínová kostra. Zdroj: Zmesi [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/]] Z jeho kostry (vynikajúci obraz) sa dá povedať, že trietylamín je dosť podobný amoniaku; Zatiaľ čo druhý má tri hydrogény, NH3, Prvý má tri etyl skupiny, n (ch2Chvály3)3. Jeho syntéza začína liečbou tekutého amoniaku etanolom, ktorý sa vyskytuje alkyláciou.
Sieť3 Môžete vytvoriť hygroskopickú soľ s HCl: hydrochlorid trietilamín, sieť3· HCl. Okrem toho sa zúčastňuje ako homogénny katalyzátor na syntéze esterov a Amidas, takže je to nevyhnutné rozpúšťadlo v organických laboratóriách.
Spolu s inými činidlami umožňuje oxidáciu primárnych a sekundárnych alkoholov na aldehydy a ketóny, respektíve. Rovnako ako amoniak je základňou, a preto môže tvoriť organické solí prostredníctvom neutralizačných reakcií.
[TOC]
Štruktúra trietylamínu
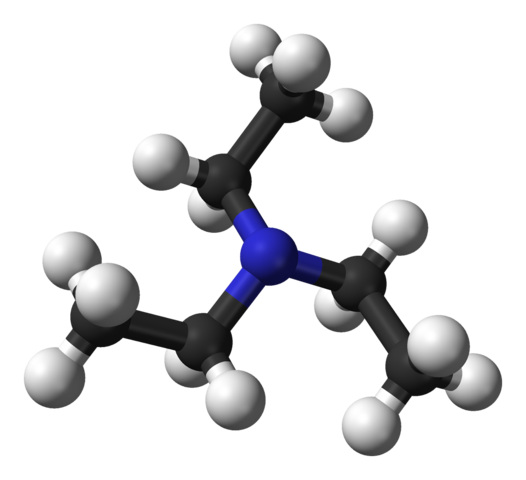 Štruktúra trietylamínu. Zdroj: Benjah-Bmm27 [verejná doména].
Štruktúra trietylamínu. Zdroj: Benjah-Bmm27 [verejná doména]. Horný obrázok ukazuje štruktúru trietylamínu s modelom guľôčok a tyčí. V strede molekuly sa nachádza atóm dusíka, ktorý predstavuje modrú guľu; A spojené s ním, tromi etyl skupinami, ako sú malé vetvy čiernych a čiernych guľôčok.
Aj keď nie sú voľným okom, na atóme dusíka existuje niekoľko zdieľaných elektrónov. Tieto dva elektróny a tri skupiny -2Chvály3 Zažívajú elektronické odpory; Ale na druhej strane prispievajú k definovaniu dipólového momentu molekuly.
Môže vám slúžiť: cykloalcanos: vlastnosti, reakcie, použitia, príkladyTakýto dipólový moment je však nižší ako napríklad v prípade dietylamínu, NHET2; A tiež mu chýba žiadna možnosť formovania vodíkových mostov.
Je to tak preto, že v trietylamíne neexistuje väzba N-H, a preto sa pozorujú drobné fúzne a varné body v porovnaní s inými amínmi, ktoré takto interagujú.
Aj keď existuje mierny moment dipólu, disperzné sily medzi etylovými skupinami čistých molekúl nie je možné vylúčiť3 susedia. Pridaním tohto účinku je opodstatnené, prečo je trialamín prchavý, vrie okolo 89 ° C, a to vďaka svojej relatívne veľkej molekulárnej hmotnosti.
Vlastnosti
Fyzický vzhľad
Bezfarebná tekutina s nepríjemným zápachom amoniaku a rýb.
Molárna hmota
101,193 g/mol.
Bod varu
89 ° C.
Bod topenia
-115 ° C. Všimnite si, ako slabé intermolekulárne sily, ktoré zjednocujú molekuly trietylamínu v ich tuhej farbe.
Hustota
0,7255 g/ml.
Rozpustnosť
Je relatívne rozpustný vo vode, 5,5 g/100 g pri 20 ° C. Pod 18,7 ° C, podľa Pubchem, je s tým dokonca miešateľný.
Okrem „vychádzania“ s vodou je tiež rozpustný v acetóne, benzéne, etanole, éteru a parafíne.
Hustota
3.49 vo vzťahu k vzduchu.
Tlak vodnej pary
57,07 mmHg pri 25 ° C.
Henry Constant
66 μmol/pa · kg.
zapaľovač
-15 ° C.
Teplota
312 ° C.
Tepelná kapacita
216,43 kj/mol.
Spaľovacie teplo
10.248 limet/g.
Odparovanie
34,84 kJ/mol.
Povrchové napätie
20,22 N/M A 25 ° C.
Index lomu
1 400 až 20 ° C.
Hrebeň
0,347 MPa · s pri 25 ° C.
Konštantná základnosť
Trietilamín má PKB rovný 3,25.
Základnosť
Základnosť tohto amínu môže byť vyjadrená nasledujúcou chemickou rovnicou:
Môže vám slúžiť: syntetické polymérySlepo3 + Ha nhet3+ + Do-
Kde je to slabý druh kyseliny. NHET pár3+Do- Tvorí to, čo sa stáva terciárnou amónnou soľou.
NHET konjugovaná kyselina3+ Je stabilnejší ako amónny, NH4+, Pretože tri etylové skupiny darujú časť svojej elektronickej hustoty na zníženie pozitívneho zaťaženia atómu dusíka; Preto je trietylamín základnejší ako amoniak (ale menej základný ako OH-).
Žiadosti
 Reakcie katalyzované trietylamínom. Zdroj: Tachymètre [verejná doména].
Reakcie katalyzované trietylamínom. Zdroj: Tachymètre [verejná doména]. Základnosť, v tomto prípade sa nukleofilita trietylamínu používa na katalyzáciu syntézy esteru a amidov zo spoločného substrátu: acylchlorid, RCOCL (vynikajúci obraz).
Tu dusíkový elektrón bezplatný pár zaútočí na karbonylovú skupinu a vytvára sprostredkovateľa; ktorý je postupne napadnutý alkoholom alebo amínom na vytvorenie esteru alebo Amida, respektíve.
V prvom riadku obrazu je vizualizovaný mechanizmus, ktorý sleduje reakciu na vytvorenie esteru, zatiaľ čo druhý riadok zodpovedá Amida. Všimnite si, že v obidvoch reakciách sa vyskytuje hydrochlorid trietylamín3· HCl, z ktorého sa katalyzátor obnoví na začatie iného cyklu.
Polyméry
Nukleofilita trietylamínu sa tiež používa na pridanie určitých polymérov, ich uzdravenie a poskytovanie väčších mas. Napríklad je súčasťou syntézy polykarbonovaných živíc, polyuretánových penín a epoxidových živíc.
Chromatografia
Jeho vzdialená amfifilita a volatilita umožňuje používať odvodené soli ako reagenty v chromatografii iónovej výmeny. Ďalším implicitným použitím trietylemínu je to, že z neho možno získať niekoľko solí terciárnych amínov, ako je napríklad triatylamínový hydrobonát, NHET3HCO3 (alebo čaj).
Môže vám slúžiť: kalorimetria: aké štúdie a aplikácieKomerčné výrobky
Používa sa ako prídavná látka pri formulácii cigariet a tabaku, konzervačných látok, podláh, príchutí, pesticídov, farbív atď.
Riziká
Výpary trietylamínu sú nielen nepríjemné, ale nebezpečné, pretože môžu dráždiť nos, hrdlo a pľúca, aby spôsobili pľúcny edém alebo bronchitídu. Podobne sú hustejšie a ťažké ako vzduch, zostávajú na úrovni zeme a presúvajú sa na možné zdroje tepla, aby následne explodovali.
Kontajnery tejto kvapaliny musia byť tak ďaleko od ohňa, pretože predstavujú bezprostredné nebezpečenstvo výbuchu.
Okrem toho kontakt s druhmi alebo činidlami, ako sú: alkalické kovy, kyselina triclooctová, dusičnany, kyselina dusičná (ako by tvorili nitrozoamíny, karcinogénne zlúčeniny), silné kyseliny, peroxidy a permanganáty.
Nemali by ste sa dotýkať hliníka, medi, zinku alebo jeho zliatiny, pretože má schopnosť ich korodovať.
Pokiaľ ide o fyzický kontakt, môže to spôsobiť alergiu a kožné vyrážky, ak je expozícia akútna. Okrem pľúc môže ovplyvniť pečeň a obličky. A čo sa týka očného kontaktu, spôsobuje to podráždenie, ktoré by mohlo dokonca poškodiť oči, ak nie sú včas liečené alebo vyčistené.
Odkazy
- Morrison, r. Tón. a Boyd, R, N. (1987). Organická chémia. 5. vydanie. Redakčný Addison-Wesley Inter-American.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. Amín. (10. vydanie.). Wiley Plus.
- Wikipedia. (2019). Triedtylamín. Zdroj: In.Wikipedia.orgán
- Milosť. (2019). Triedtylamín. Získané z: Sigmaaldrich.com
- Národné centrum pre biotechnologické informácie. (2019). Triedtylamín. Databáza pubchem. CID = 8471. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Toxikologická dátová sieť. (s.F.). Triedtylamín. Získané z: Toxnet.NLM.NIH.Vláda
- Ministerstvo zdravotníctva v New Jersey. (2010). Triedtylamín. Získané z: NJ.Vláda
- « 10 kuriozít o stredoveku, ktoré vás prekvapia
- Isoamilico alkoholová štruktúra, vlastnosti, použitie a riziká »

