Isoamilico alkoholová štruktúra, vlastnosti, použitie a riziká
- 3278
- 531
- MUDr. Žigmund Boška
On Izoamylalkohol Je to organická zlúčenina, ktorej vzorec je (ch3)2Štiepka2Chvály2Oh. Chemicky povedané je rozvetvený primárny alkohol a predstavuje jeden z izomérov pentanolu, nazývaný alalkoholy (C5H12Buď).
Rovnako ako mnoho alkoholov s nízkou molekulovou hmotnosťou, je to bezfarebná tekutina pri teplote miestnosti. To umožňuje a uľahčuje, že sa používa ako rozpúšťadlo pre rôzne aplikácie; Okrem toho, keď po vyradení ekosystému nevykazuje príliš veľa negatívnych účinkov na ekosystém.
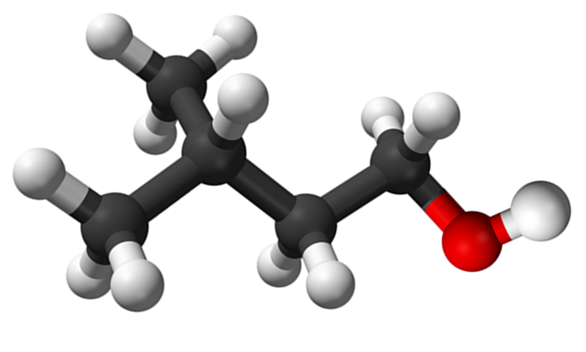
 Izoamililná molekula alkoholu. Zdroj: Claudio Pistilli de Wikipedia.
Izoamililná molekula alkoholu. Zdroj: Claudio Pistilli de Wikipedia. Aj keď je to sprostredkovateľský materiál v syntéze amilo acetátu na vypracovanie banánových vôní, jeho vlastný zápach je nepríjemný a podobný ako v hruškách.
Okrem toho, že slúži ako rozpúšťadlo viacerých biologických látok a ako sprostredkovateľ v syntéze iných acetátov, znižuje povrchové napätie určitých priemyselných formulácií, čím bráni tvorbe peny. Preto sa používa v mikroemulgovaných systémoch.
Pokiaľ ide o jeho prirodzený pôvod, v Horomonas of the Hornets a v čiernych hľuzoch.
[TOC]
Izoamilicová štruktúra
Na hornom obrázku bola zobrazená molekula izoamylalalkoholu predstavovaná s guľovými a stĺpcovými modelmi. Napravo od toho, červenkastá guľa zodpovedá atómu kyslíka OH skupiny, ktorá je charakteristická pre všetky alkoholy; Kým vľavo, je sýtená kostra s metylovou skupinou, cho3, Brakovanie štruktúry.
Z molekulárneho hľadiska je táto zlúčenina dynamická na to, že má atómy s hybridami SP3, uľahčenie rotácie ich prepojení; Pokiaľ to nespôsobí zatmenie OH a Cho3.
Za zmienku stojí aj jeho amfifilikálna charakteristika: má apolárny alebo hydrofóbny koniec, ktorý predstavuje reťazec (CH3)2Štiepka2Chvály2-, a polárna alebo hydrofilná hlava, OH skupina. Táto definícia dvoch konkrétnych oblastí rôznych polarity robí z tohto alkoholu napätie; A odtiaľ je to kvôli svojej aplikácii na mikroemulzie.
Môže vám slúžiť: Pravidlo pákyIntermolekulárne interakcie
Vzhľadom na prítomnosť skupiny OH predstavuje izoamililná molekula alkoholu trvalý dipólový moment. Preto dipól-dipol.
Zatiaľ čo vetva hlavných reťazcov znižuje účinné interakcie medzi molekulami, vodíkové mosty v tomto alkoholu kompenzujú tento zostup, čo spôsobuje, že kvapalina sa privaje pri 131 ° C, teplota vyššia ako v bode varu vody.
Nestáva sa to so svojím pevným alebo „ľadom“, ktorý sa topí na -117 ° C, čo naznačuje, že jeho intermolekulárne interakcie nie sú dostatočne silné na to, aby udržali svoje molekuly usporiadané; Najmä ak skupina CHO3 že vetvy hlavného reťazca zabraňuje lepšiemu kontaktu medzi molekulami.
Vlastnosti
Fyzický vzhľad
Bezfarebná tekutina.
Vôňa
Odmieta nepríjemnú vôňu podobnú hruške a má ostrú chuť.
Molárna hmota
88,148 g/mol.
Hustota
0,8104 g/ml pri 20 ° C. Je preto menej hustá ako voda.
Hustota
Je 3,04 -krát hustejší ako vzduch.
Tlak vodnej pary
2,37 mmHg pri 25 ° C.
Bod varu
131,1 ° C.
Bod topenia
-117,2 ° C.
zapaľovač
43 ° C (zatvorený šálka).
Teplota
340 ° C.
Rozpustnosť
Je relatívne rozpustný vo vode: 28 g/l. Dôvodom je, že vysoko polárne molekuly vody necítia osobitnú afinitu k sýtenému izoamylalalkoholu reťazca. Ak by sa zmiešali, pozorovali by sa dve fázy: spodná z nich, zodpovedajúca vode a nadriadené, fáza izoamylalalkoholu.
Naopak, je oveľa rozpustnejší v menších polárnych rozpúšťadlách, ako je: acetón, éter, chloroforma, etanol alebo ľadová kyselina octová; a dokonca aj v ropnom éteru.
Môže vám slúžiť: laboratórny teplomer: Charakteristiky, čo je pre, použitie, príkladyHrebeň
3 738 cp pri 25 ° C.
Povrchové napätie
24,77 DIN/cm A 15 ° C.
Index lomu
1 4075 až 20 ° C.
Tepelná kapacita
2 382 kj/g · k.
Žiadosti
Surový materiál
Z izoamilizačného alkoholu Ostatné estery, tiofén a drogy, ako je amilo dusitan, VALOLOL (Isavalerate mentil), Bromisoval (Bromobalerilurea), Corvalol (Callerian Tranquanar) a Barmarbital) (Amobarbital) (Amobarbital) (Amobarbital).
Vône
Okrem toho, že sa použije na syntézu amilo acetátu, ktorý má arómu banánov, sa z nej tiež získavajú ďalšie ovocné vône, ako sú marhuľové, pomaranče, slivka, čerešňa a slad. Preto je to nevyhnutný alkohol pri vypracovaní mnohých jedlých alebo kozmetických výrobkov.
Antispumant
Znížením povrchového napätia podporuje jeho použitie v mikroemulgovaných systémoch. Prakticky sa vyhnite zrýchlenej tvorbe bublín, čím sa ich veľkosť zmenšuje, aby ste ich prerušili.
Pomáha tiež lepšie definovať rozhranie medzi vodnými a organickými fázami počas extrakcií; Napríklad sa pridá do zmesi extraktorovej zmesi fenol-chloroform v pomere 25: 1. Táto technika je určená na extrakciu DNA.
Extrakcia
Isoamylalkohol tiež umožňuje extrahovať tuky alebo oleje z rôznych vzoriek, napríklad mlieko. Rozpustite tiež parafínový vosk, atramenty, gumy, lakquery a estery celulózy.
Pokračovanie extrakciami, s ním môžete získať kyselinu fosforečnú z roztokov minerálnych minerálov železa.
Riziká
Skladovanie
Rovnako ako každá tekutina, ktorá vydáva pachy, môže predstavovať bezprostredné riziko požiaru, ak je miesto, kde je jeho teplota príliš uložená, ešte viac, ak už existuje zdroj tepla.
Za týchto podmienok jednoducho pôsobí ako palivo, kŕmi plamene a dokonca využíva jeho nádobu. Keď horí, uvoľnite výpary, ktoré môžu ovplyvniť zdravie a spôsobiť udusenie.
Môže vám slúžiť: kvantitatívna analýza v chémii: merania, prípravaĎalšími príčinami, ktoré je zapálený izoamilitický alkohol, je ich zmiešanie alebo prinútiť ho reagovať s látkami ako: peroxidy, brome.
Zdravie
Pri kontakte s pokožkou ju môžete dráždiť a vysušiť. Príznaky sú však závažnejšie, ak sa vdýchnuli príliš dlho (kašeľ, popáleniny nosa, krk a pľúca) alebo ak požití (bolesť hlavy, nevoľnosť, hnačka, zvracanie, závraty a strata vedomostí).
A nakoniec, keď ich vyliate do očí, dráždi ich a môže im dokonca poškodiť ireverzibilne. Našťastie jej vôňa „alkoholických hruškov“ vám umožňuje zistiť ju v prípade úniku alebo rozliatia; Okrem toho je to zlúčenina, s ktorou sa musí manipulovať s rešpektom.
Odkazy
- Morrison, r. Tón. a Boyd, R, N. (1987). Organická chémia. 5. vydanie. Redakčný Addison-Wesley Inter-American.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. Amín. (10. vydanie.). Wiley Plus.
- Wikipedia. (2019). Izoamylalkohol. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie. (2019). Izoamylalkohol. Databáza pubchem. CID = 31260. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Zhang Yu & Muhammed Mamoun. (17. september 2008). Extrakcia kyseliny fosforečnej z roztokov dusičnanov s izoamylalkoholom. Extrakcia rozpúšťadla a výmena iónov Zväzok 6, 1988 - vydanie 6. doi.org/10.1080/07366298808917973
- Ministerstvo zdravotníctva v New Jersey. (2008). Izoamylalkohol. [PDF]. Získané z: NJ.Vláda
- Chem. (2019). Izoamylalkohol. Získané z: Kat-chem.Hu
- Chemoxy International Ltd. (s.F.). Izoamylalkohol. Obnovené z: chemoxy.com

