Neutrálny atóm
- 1072
- 269
- Václav Višňovský
Čo je neutrálny atóm?
A neutrálny atóm Je to ten, ktorý nemá elektrický náboj v dôsledku kompenzácie medzi počtom svojich protónov a elektrónov. Obe sú elektricky naložené subatomické častice.
Protóny sú aglomerované vedľa neutrónov a tvoria jadro; zatiaľ čo elektróny sú rozmazané definovaním elektronického oblaku. Keď sa počet protónov v atóme, ktorý sa rovná jeho atómovému číslu (z), sa rovná počtu elektrónov, hovorí sa, že medzi elektrickými nábojmi v rámci atómu existuje kompenzácia medzi elektrickými nábojmi.
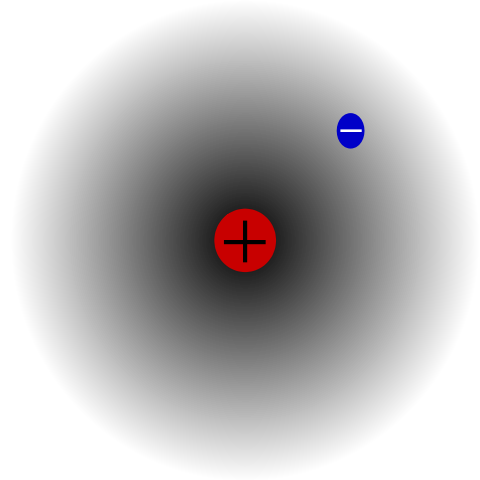
 Atóm vodíka. Zdroj: Mets501 cez Wikipedia.
Atóm vodíka. Zdroj: Mets501 cez Wikipedia. Existuje napríklad atóm vodíka (vynikajúci obraz), ktorý má protón a elektrón. Protón je umiestnený v strede atómu ako jeho jadro, zatiaľ čo elektrón obieha okolitý priestor a ponecháva oblasti menšej elektronickej hustoty, keď sa pohybuje od jadra.
Toto je neutrálny atóm, pretože je pravda, že Z sa rovná počtu elektrónov (1p = 1e). Keby atóm H stratil tento jediný protón, atómový polomer bol pokrčený plecami a zvíťazil by s zaťažením protónu, čím sa stal katiónom+ (Hydron). Keby na druhej strane vyhral elektrón, boli by dva elektróny a stali by sa aniónom-- (Hydrid).
Neutrálny atóm iónov
Pre príklad neutrálneho atómu H sa zistilo, že je splnené, že počet protónov sa rovná počtu elektrónov (1p = 1e); situácia, ktorá sa nestane s iónmi odvodenými z Strata alebo zisk elektrónu.
Ióny sú tvorené zmenou počtu elektrónov, buď preto, že atóm vyhral (-) alebo ich stratil (+).
Môže vám slúžiť: rozptýlená fázaV atóme katiónov H+ Valencia solitárneho protónu prevláda tvárou v tvár celkovej neprítomnosti elektrónu (1p> 0e). To platí pre všetky ostatné ťažšie atómy (NP> NE) periodickej tabuľky.
Aj keď prítomnosť pozitívneho bremena sa môže zdať zanedbateľná, diagonálne mení charakteristiky predmetného prvku.
Na druhej strane, v atóme aniónu h- Záporné zaťaženie týchto dvoch elektrónov prevláda pred jediným protónom jadra (1p<2e). Igualmente, los demás aniones de mayor masa tienen un exceso de electrones en comparación al número de protones (np
Na vs na+
Známejším príkladom je napríklad kovový sodík. Jeho neutrálny atóm, Na, s z = 11, má 11 protónov; Preto musí existovať 11 elektrónov, aby sa kompenzovalo kladné zaťaženie (11p = 11e).
Sodík pre to, že je vysoko elektropozitívny kovový prvok, veľmi ľahko stráca svoje elektróny; V tomto prípade stráca iba jednu, vrstvu Valencie (11p> 10e). Takto sa vytvára katión+, ktorý interaguje elektrostaticky s aniónom; Ako chlorid, CL-, V soli soľného chloridu, NaCl.
Kovový sodík je jedovatý a korozívny, zatiaľ čo jeho katión je dokonca prítomný vo vnútri buniek. To ukazuje, ako sa vlastnosti prvku môžu drasticky meniť, keď vyhrá alebo stráca elektróny.
Na druhej strane, Nion na- (Soduro, hypoteticky) neexistuje; A aby som bol schopný formovať, bolo by to extrémne reaktívne, pretože je v rozpore s chemickou povahou sodíka, aby vyhral elektróny. Potom- Mala by to 12 elektrónov, čo by prekonalo pozitívny náboj svojho jadra (11p<12e).
Môže vám slúžiť: molekulárny kyslík: štruktúra, vlastnosti, použitieNeutrálne molekuly
Atómy sú kovalentne spojené, aby sa vznikli molekúl, ktoré sa môžu nazývať aj zlúčenina. V molekule nemôže byť izolované ióny; Namiesto toho existujú atómy s pozitívnym alebo negatívnym formálnym zaťažením. Tieto zaťažené atómy ovplyvňujú čisté zaťaženie molekuly a transformujú ju na polysymický ión.
Aby bola molekula neutrálna, súčet formálnych zaťažení jeho atómov sa musí rovnať nule; Alebo, jednoduchšie, všetky jeho atómy sú neutrálne. Ak sú atómy, ktoré tvoria molekulu neutrálne, bude to tiež.
Napríklad máte molekulu vody, h2Ani. Jeho dva atómy H sú neutrálne, rovnako ako atóm kyslíka. Nemôžu byť zastúpené rovnakým spôsobom, ako je to znázornené na obrázku atómu vodíka; Pretože, hoci sa jadro nemení, elektronický oblak.
Hydronio ión, h3Ani+, Na druhej strane má atóm kyslíka s pozitívnym čiastočným zaťažením. To znamená, že v tomto polyiatomickom ióne stráca elektrón, a preto je jeho počet protónov väčší ako počet svojich elektrónov.
Príklady neutrálnych atómov
Kyslík
Neutrálny atóm kyslíka má 8 protónov a 8 elektrónov. Keď vyhrá dva elektróny, tvorí to, čo je známe ako oxid anión, alebo2-. V ňom prevládne záporné zaťaženia, ktoré majú prebytok dvoch elektrónov (8p<10e).
Neutrálne atómy kyslíka majú vysokú tendenciu reagovať a spájať sa so sebou do formy alebo2. Z tohto dôvodu nie sú tam žiadne atómy alebo „voľné“ do vášho osudu a bez toho, aby ste s ničím reagovali. Všetky známe reakcie pre tento plyn sa udeľujú molekulárnym kyslíkom, alebo2.
Môže vám slúžiť: zásadné kovyMeď
Meď má 29 protónov a 29 elektrónov (okrem neutrónov). Na rozdiel od kyslíka sa ich neutrálne atómy nachádzajú v prírode kvôli ich kovovej väzbe a relatívnej stabilite.
Rovnako ako sodík, má tendenciu strácať elektróny namiesto toho, aby ich vyhral. Vzhľadom na svoju elektronickú konfiguráciu a ďalšie aspekty môžete stratiť jeden alebo dva elektróny, stať sa Cupros+, o Cuprico, Cu2+, respektíve.
Cucion Cu+ Má menší elektrón (29p<28e), y el Cu2+ stratil dva elektróny (29p<27e).
Šľachetné plyny
Noblené plyny (on, NE, AR, KR, XE, RN) sú jedným z mála prvkov, ktoré existujú vo forme ich neutrálnych atómov. Jeho atómové čísla sú: 2, 10, 18, 36, 54 a 86, respektíve. Nevyhrávajú ani nestratia elektróny; Aj keď xenón, XE, môže tvoriť zlúčeniny s fluórom a stratiť elektróny.
Zliatiny
Kovy sú chránené pred koróziou, ktoré si môžu udržiavať svoje neutrálne atómy spojené s kovovými väzbami. V zliatinách zostávajú atómy tuhých kovov (väčšinou) neutrálne. Napríklad v mosadze existujú neutrálne atómy Cu a Zn.
Odkazy
- Čo je neutrálny atóm? Získané z: Úvod do fyziky.com
- Príklad neutrálnych atómov. Vedecký. Obnovené z: vedeckých.com

