Toluénová štruktúra, vlastnosti, použitia, získanie
- 1416
- 118
- Ing. Ervín Petruška
On Toluén Je to aromatický uhľovodík, ktorého kondenzovaný vzorec je C6H5Chvály3 alebo phch3 a to pozostáva z metylovej skupiny (ch3) spolu s benzénnym kruhom alebo fenylovou skupinou (pH). Prirodzene sa nachádza v rope, v uhlí, v sopečných emanáciách a na niektorých stromoch, ako napríklad Tolú de América na juhu.
Toto charakteristické rozpúšťadlo vône sa používa hlavne ako priemyselná surovina a ako riedenie farby. Používa sa tiež na elimináciu parazitov prítomných u mačiek a psov, ako sú ascaridy a anylostómy.
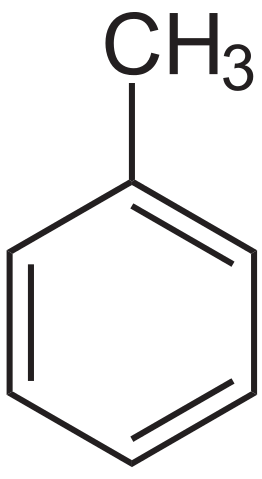
 Toluén štrukturálny vzorec. Zdroj: Neurotoger cez Wikipedia.
Toluén štrukturálny vzorec. Zdroj: Neurotoger cez Wikipedia. Toluén bol prvýkrát izolovaný Pierre-Joseph Pelletier a Philippe Walter, v roku 1837 z Pine Oil. Následne ho Henri Etienne Sainte-Claire Deville v roku 1841 izoloval od balzamu Tolú a poukázal na to, že jeho produkt bol podobný predtým izolovaným. V roku 1843 ho Berzelius pokrstil ako Toluin.
Väčšina toluénu sa získava ako laterálny alebo sekundárny produkt v procesoch výroby plynu a premeny uhlia na koks. Vytvára sa tiež reakciami uskutočnenými v laboratóriu, napríklad benzénovou reakciou s metylchloridom.
[TOC]
Štruktúra
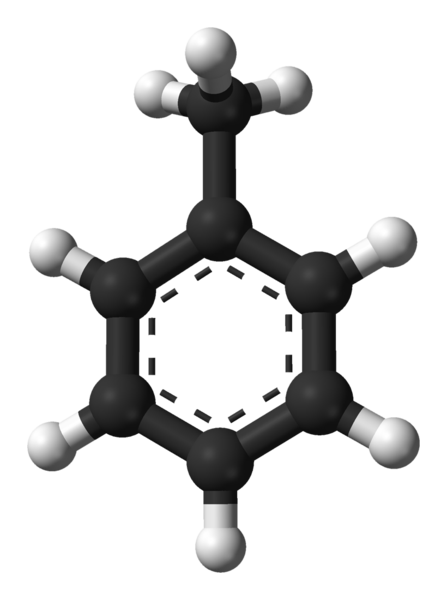 Molekulárna štruktúra toluénu. Zdroj: Ben Mills Via Wikipedia.
Molekulárna štruktúra toluénu. Zdroj: Ben Mills Via Wikipedia. Na vynikajúcom obraze máme molekulárnu štruktúru toluénu reprezentovanú modelom guľôčok a stĺpcov. Všimnite si, že to vyzerá presne rovnako, ako je uvedený štrukturálny vzorec, s rozdielom, že to nie je úplne plochá molekula.
V strede benzénového kruhu, ktorý sa v tomto prípade môže vnímať ako fenylová skupina, pH, jeho aromatický charakter je zvýraznený bodkovanými čiarami. Všetky atómy uhlíka majú hybridizáciu SP2, Okrem skupiny Cho3, ktorého hybridizácia je SP3.
Z tohto dôvodu nie je molekula úplne plochá: cho vodídové3 Nachádzajú sa v rôznych uhloch roviny benzénu.
Môže vám slúžiť: ionizačná konštantaToluén je apolárna, hydrofóbna a aromatická molekula. Jeho intermolekulárne interakcie sú založené na disperzných silách v Londýne av dipolo-dipoloch interakciách, pretože centrum kruhu je „zaťažené“ elektronickej hustoty poskytovanej CH3; Zatiaľ čo atómy vodíka majú nízku elektronickú hustotu.
Preto má toluén niekoľko typov intermolekulárnych interakcií, ktoré udržiavajú molekuly svojho kvapaliny. To sa odráža v jeho bode varu, 111 ° C, čo je vysoké vzhľadom na to, že ide o apolárne rozpúšťadlo.
Vlastnosti
Fyzický vzhľad
Bezfarebná a priehľadná tekutina
Molárna hmota
92 141 g/mol
Vôňa
Sladké, aker a podobné ako u benzénu
Hustota
0,87 g/ml pri 20 ° C
Bod topenia
-95 ° C
Bod varu
111 ° C
Rozpustnosť
Toluén má opovrhnuteľnú rozpustnosť vo vode: 0,52 g/l pri 20 ° C. To je spôsobené rozdielom v polarite medzi toluénom a vodou.
Na druhej strane je toluén rozpustný alebo v tomto prípade miešateľný, s etanolom, benzénom, etyléterom, acetónom, chloroformom, kyselinou glaciálnou octovou a disulfidom uhlíka; to znamená, že je lepšie solubilizovaný v menších polárnych rozpúšťadlách.
Index lomu (nD)
1 497
Hrebeň
0,590 cp (20 ° C)
zapaľovač
6 ° C. Tolluene sa musí manipulovať v táboroch extrahovania plynu a čo najďalej od akéhokoľvek plameňa.
Hustota
3,14 vo vzdušnom vzťahu = 1. To znamená, že ich výpary sú trikrát hustejšie ako vzduch.
Tlak vodnej pary
2.8 kPa pri 20 ° C (asi 0 približne 0.27 ATM).
Teplota
480 ° C
Rozklad
Môže rázne reagovať s oxidačnými materiálmi. Keď sa zahrieva na rozklad, vydáva aker a dráždi dym.
Povrchové napätie
29,46 MN pri 10 ° C
Dipolárny moment
0,36 d
Reaktivita
Toluén je náchylný na chloráciu, aby sa produkoval orto-chlórtoluén a para-cllorotoluén. Je tiež ľahké nitrifikovať produkciu nitrotoluénu, ktorý je surovinou farbiva.
Môže vám slúžiť: atómová váhaČasť toluénu sa kombinuje s tromi časťami kyseliny dusičnej, ktorá spôsobuje trinitrotoluén (TNT): jeden z najznámejších výbušnín.
Podobne toluén prežíva sulfonáciu na generovanie kyselín O-toluen-sulfonickú a p-toluen-sulfónovú kyselinu, ktoré sú surovinou na výrobu farbív a sachcharínu.
Toluénová metylová skupina zažíva stratu vodíka v dôsledku pôsobenia silnej bázy. Metylová skupina je tiež náchylná na oxidáciu, takže reaguje s permanganátom draslíka, aby spôsobil vznik benzoickej a benzaldehydovej kyseliny.
Žiadosti
Priemyselný pracovník
 TNT, najmrmejšia výbušná zo všetkých, sa vyskytuje toluénom ako hlavná surovina. Zdroj: Pixabay.
TNT, najmrmejšia výbušná zo všetkých, sa vyskytuje toluénom ako hlavná surovina. Zdroj: Pixabay. Toluén sa používa pri vypracovaní obrazov, riedidiel farieb, leštených na nechty, lepidla alebo ďasná pasty, lakquery, atramenty, nylon, plasty, polyuretánová pena, väčšina olejov, vinylové orgány, lieky, farbivá, parfumy (TNT).
Rovnakým spôsobom sa toluén používa vo forme toluenosulfonados pri výrobe detergentu. Toluén má tiež veľký význam pri výrobe plastových cementov, kozmetických farbiacich podielov, nemrznúcich zmlúv, atramentov, asfaltu, trvalých markerov, kontaktných cementov atď.
Rozpúšťadlo a riedidlo
Toluene sa používa pri riedení obrazov, čo uľahčuje jeho aplikáciu. Používa sa na rozpustenie okrajov polystyrénových súprav, čím umožňuje spojenie častí, ktoré tvoria modely mierky lietadiel. Okrem toho sa používa pri extrakcii prírodných produktov z rastlín.
Toluén je atramentové rozpúšťadlo, ktoré sa používa v rytého otvoru. Cementy zmiešané s gumou a toluénom sa používajú na pokrytie veľkého počtu výrobkov. Podobne sa toluén používa ako rozpúšťadlo v tlačových atramentoch, lakkeroch, kožených koželách, lepidle a dezinfekčných prostriedkoch.
Môže vám slúžiť: molárne absorbovanieA ešte zaujímavejšie, toluén sa používa ako rozpúšťadlo uhlíkových nanomateriálov (ako sú nanotrubičky) a fullerenos.
Ďalší
Zmes benzénu, toluénu a xylénu (BTX) sa pridá do benzínu, aby sa zvýšil jeho oktán. Toluén je prídavnou látkou plynu a vysokej oktánovej rezervy. Používa sa tiež pri vypracovaní NAFTA.
Toluén pomáha pri odstraňovaní niektorých druhov askáridov a anquilostomos, ako aj Tenias, ktoré sú parazitmi mačiek a psov.
Získanie
Väčšina toluénu sa získava z destilovaných produktov z ropy, generovaných počas uhľovodíkovej pyrolýzy (parné krakovanie). Katalytická reforma ropných výparov predstavuje 87 % produkovaného toluénu.
Ďalších 9 % toluénu z benzínu pyrolýzy vyrobeného počas výroby etylénu a propylénu.
Hulla decht z koksových pecí prispieva 1 % produkovaného toluénu, zatiaľ čo zvyšné 2 % sa získa ako vedľajší produkt výroby úseku.
Škodlivé účinky
Tolluén je rozpúšťadlo, ktoré sa vdýchne, aby sa dostal vysoko, pretože má narkotický účinok, ktorý ovplyvňuje fungovanie centrálneho nervového systému. Tolluene vstupuje do tela požitie, vdýchnutie a absorpciu cez pokožku.
Na úrovni expozície 200 ppm, excitácia, eufória, halucinácie, skreslené vnímanie, bolesti hlavy a závraty sa môžu vyskytnúť. Zatiaľ čo vyššie úrovne vystavenia toluénu môžu spôsobiť depresiu, ospalosť a stupor.
Keď inhalácia presahuje koncentráciu 10.000 ppm, je schopný vyvolať smrť jednotlivca v dôsledku zlyhania dýchacích ciest.
Odkazy
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10th Vydanie.). Wiley Plus.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Morrison a Boyd. (1987). Organická chémia. (Piate vydanie). Addison-Wesley Iberoamericana.
- Národné centrum pre biotechnologické informácie. (2020). Toluén. Databáza pubchem., CID = 1140. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Wikipedia. (2020). Toluén. Zdroj: In.Wikipedia.orgán
- Engineering Toolbox, (2018). Toluén - Termofyzikálne vlastnosti. [Online] obnovené z: EngineeringToolbox.com
- Tobolka. (s.F.). Toluén. Získané z: Vedantu.com
- « Deštruktívna interferenčná vzorec a rovnice, príklady, cvičenie
- Štruktúra polyvinylpirrolidónu, vlastnosti, použitie, vedľajšie účinky »

