Charakteristiky tyrozínu, štruktúra, funkcie, výhody
- 2186
- 614
- MUDr. Žigmund Boška
Ten Tyrozín (Tyr, y) je jednou z 22 aminokyselín, ktoré tvoria proteíny všetkých buniek prítomných v živých bytostiach. Na rozdiel od iných aminokyselín, ako je valín, treonín, tryptofán, leucín, lyzín a ďalšie, tyrozín je „podmienečne“ v podstate esenciálny aminokyselina.
Názov „tyrozín“ je odvodený z gréckeho slova "Streľba", Čo znamená syr, pretože táto aminokyselina sa prvýkrát objavila v tomto jedle. Tento termín bol vytvorený v roku 1846 Liebig, ktorý zmiešal syr s hydroxidom draselného a získal neznámu zlúčeninu, ťažko rozpustný vo vode.
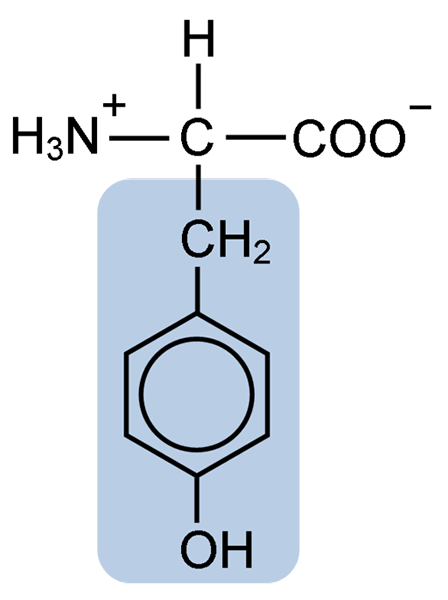
 Chemická štruktúra tyrozínovej aminokyseliny (zdroj: klavecín [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons)
Chemická štruktúra tyrozínovej aminokyseliny (zdroj: klavecín [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons) Po počiatočnom opise sa ostatní vedci, ako sú Warren de la Rue a Hinterberger, získaní z kokoidného hmyzu a proteínov rohov. Jeho oddelenie od hydrolýzy iných proteínov s kyselinou chlorovodíkovou bola opísaná v roku 1901 Mörnerom.
Všeobecne sa táto aminokyselina získava u cicavcov vďaka hydroxylácii fenylalanínu, hoci sa tiež absorbuje v čreve z proteínov konzumovaných potravinami.
Tyrozín má v ľudskom tele viac funkcií a medzi nimi najdôležitejšie sú substrát na produkciu neurotransmiterov a hormónov, ako je adrenalín a hormón štítnej žľazy.
[TOC]
Charakteristika
Tyrozín váži približne 180 g/mol a jeho skupina R alebo bočný reťazec má 10 -disociačnú konštantu 10.07. Jeho relatívna hojnosť v bunkových proteínoch nepresahuje 4%, ale má viac základných funkcií pre fyziológiu človeka.
Táto aminokyselina patrí do skupiny aromatických aminokyselín, v ktorých sú tiež fenylalanín a tryptofán. Členovia tejto skupiny majú aromatické krúžky vo svojich R R alebo postranných reťazcoch a zvyčajne sú to hydrofóbne alebo apolárne aminokyseliny.
Rovnako ako tryptofán, tyrozín absorbuje ultrafialové svetlo a je jedným z aminokyselinových odpadov zodpovedných za absorpciu svetla na 280 nm mnohých proteínov, takže je užitočný pre jeho charakterizáciu.
Považuje sa za základnú „podmienečne“ aminokyselinu, pretože jej biosyntéza v ľudskej bytosti závisí od fenylalanínu, esenciálneho aminokyseliny. Ak telo spĺňa svoje denné požiadavky na fenylalanín, tyrozín sa môže bez problémov syntetizovať a nie je to obmedzujúce aminokyseliny.
Ak však strava chýba vo fenylalanínu, telo bude mať nielen nerovnováhu tejto aminokyseliny, ale aj tyrozín. Je tiež dôležité zdôrazniť, že reakcia syntézy tyrozínu z fenylalanínu nie je reverzibilná, takže tyrozín nemôže uspokojiť bunkové potreby fenylalanínu.
Tyrozín tiež patrí do skupiny aminokyselín s duálnymi funkciami pri produkcii glukogénnych a ketogénnych metabolických sprostredkovateľov, ktoré sa podieľajú na syntéze glukózy pre mozog a na tvorbe ketónových telies v pečeni.
Štruktúra
Rovnako ako ostatné aminokyseliny, tyrozín alebo β-parahydroxyphenyl-a-aminokyselina propiónová, je to a-aminokyselina, ktorá má centrálny atóm uhlíka, nazývaný uhlík a, ktorý je chirálny, pretože je spojený Štyri rôzne substituentné atómy alebo molekuly.
Tento királny uhlík je spojený s dvoma charakteristickými skupinami aminokyselín: aminoskupina (NH2) a karboxylová skupina (COOH). Zdieľa tiež jednu zo svojich väzieb s atómom vodíka a zostávajúca väzba je obsadená R alebo bočným reťazcom každej aminokyseliny.
V prípade tyrozínu táto skupina pozostáva z aromatického kruhu spojeného s hydroxylovou (OH) skupinou, ktorá mu dáva schopnosť tvoriť vodíkové mosty s inými molekulami a ktorý jej poskytuje nevyhnutné funkčné charakteristiky pre určité enzýmy.
Môže vám slúžiť: baroreceptoryFunkcia
Tyrozín je základnou zložkou mnohých proteínov s veľkou rozmanitosťou biologických aktivít a funkcií.
U ľudí a iných cicavcov sa táto aminokyselina využíva v nervových a obličkových tkanivách pre syntézu dopamínu, adrenalínu a norepinefrínu, tri neurotransmitery súvisiace s katecholaminergiou súvisiacimi s nanajvýš dôležitosťou pre fungovanie tela.
Je tiež nevyhnutná pre syntézu chráničov ultrafialového žiarenia (UV), ako je melanín; niektorých analgetík, ako sú endorfíny a antioxidačné molekuly, ako je vitamín E.
Podobne táto aminokyselina slúži na syntézu hormónov tiramínu, chobotnice a štítnej žľazy prostredníctvom organizácie jódu v tyrozínovom zvyšku Tyoglobulín.
Tiramín je vazoaktívna molekula nachádzajúca sa v ľudskom tele a Octopamín je amín súvisiaci s norprenalínom.
Všetky tieto funkcie tyrozínu sú možné vďaka jeho získaniu z proteínov stravy alebo hydroxyláciou fenylalanínu s pečeňou ako hlavným systémom systémového dodávky uvedených aminokyselín.
Funkcie v rastlinách
Tyrozín a niektorí sprostredkovatelia generovaní počas ich biosyntézy kŕmia biosyntetické cesty metabolitov špecializovaných na obranu, na príťažlivosť opeľovačov, na elektronickú transport a štrukturálnu podporu.
Biosyntéza
U človeka sa tyrozín získava z diéty alebo syntetizuje v jednom kroku pečeňovými bunkami z fenylalanínu, esenciálnej aminokyseliny, prostredníctvom reakcie katalyzovanej enzymatickou komplexom fenylalanín hydroxylázy.
Tento komplex má aktivitu oxygenázy a je prítomný iba v pečeni ľudí alebo iných cicavcov. Reakcia syntézy tyrozínu znamená prenos atómu kyslíka do polohy pre aromatického kruhu fenylalanínu.
Táto reakcia dochádza v rovnakom čase, keď sa tvorí molekula vody v dôsledku redukcie iného atómu molekulárneho kyslíka a redukčná sila prispieva priamo NADPH konjugovaným s tetrahydropterínovou molekulou, ktorá je podobná ako v prípade kyseliny kyseliny listovej.
Biosyntéza v rastlinách
V rastlinách sa syntetizuje tyrozín novo Po prúde od trasy „Shikimato“, ktorá živí ďalšie biosyntetické cesty iných aromatických aminokyselín, ako je fenylalanín a tryptofán.
V týchto organizmoch je syntéza založená na zlúčenine známeho ako „corismato“, ktorá je konečným produktom trasy Shikimato a navyše spoločný prekurzor všetkých aromatických aminokyselín, určitých vitamínov a rastlinných hormónov.
Korizmát sa premieňa na predslov katalytickým účinkom enzýmu korizmátu mutasa a je to prvý „spáchaný“ krok v syntéze tyrozínu a fenylalanínu v rastlinách.
Prednastinu sa premieňa na tyrozín oxidačnou dekarboxyláciou a transamináciou, ktorá sa môže vyskytnúť v akomkoľvek poradí.
V jednej z biosyntetických trás môžu byť tieto kroky katalyzované špecifickými enzýmami známymi ako prefenát-špecifický dehydrogenáza (PDH) (ktoré premieňa predslov na 4-hydroxyphenylpyruphenylpyruvát (HPP) a tyrozín aminotransferázy (ktorá produkuje tpppín z hppp), tppp), tppp), tppp), tppp),, tppp),, tppp),, tyrozín aminotransferáza (ktorá produkuje tppppín z hpppp),, tpppp),,, tppp),, hppp),, tppp),, hppp),, tyrozín aminotransferáza (ktorá produkuje tpppp), od tpppp),, hppp),, hppp),, Hppp),, HPP) ( respektíve.
Ďalšia cesta syntézy tyrozínu z predslovu znamená transamináciu prednasu na neproteinogénnu aminokyselinu nazývanú L-arogenát, katalyzovaná enzýmom preenát aminotransferáza.
L-arogenát následne podlieha oxidačnej dekarboxylácii vytvorenia tyroxínu, reakciu smerovanú enzýmom tyrozínom-špecifickým dehydrogenázou, tiež známa ako ADH, tiež známa ako ADH.
Rastliny prednostne používajú cestu archiátu, zatiaľ čo väčšina mikróbov syntetizuje tyrozín z HPP odvodeného z prednasátu.
Regulácia
Ako platí pre väčšinu biosyntetických trás aminokyselín, rastliny majú prísny systém regulácie syntézy aromatických aminokyselín vrátane tyrozín.
Môže vám slúžiť: vynikajúce monštrum: vlastnosti, biotop, starostlivosť, vlastnostiV týchto organizmoch dochádza k regulácii na mnohých úrovniach, pretože mechanizmy, ktoré kontrolujú cestu shikimato, tiež kontrolujú produkciu tyrozínu, čo je aj ich vlastné regulačné mechanizmy.
Požiadavky tyrozínu a preto sú tuhosť v regulácii ich biosyntézy špecifické pre každý druh rastlín.
Degradácia
Degradácia alebo katabolizmus tyrozínu vedie k tvorbe fumarátu a acetoacetátu. Prvý krok tejto trasy spočíva pri premene aminokyseliny na 4-hydroxyfenylpypypypát cytosolickým enzýmom známym ako aminotransferáza tyrozín.
Táto aminokyselina sa môže tiež transaminovať v mitochondriách hepatocytov enzýmom aspartátu aminotransferázy, hoci tento enzým nie je v normálnych fyziologických podmienkach veľmi dôležitý.
Degradáciou tyrozínu môže dôjsť. Sukcinyl-acetát je najsilnejší enzýmový inhibítor zodpovedný za syntézu skupiny hemmo, dehydratáza kyseliny 5-aminolevulínovej kyseliny kyseliny kyseliny kyseliny.
Syntéza adrenalínu a norepinefrínu
Ako už bolo uvedené, tyrozín je jedným z hlavných substrátov syntézy dvoch veľmi dôležitých neurotransmiterov pre ľudské telo: adrenalín a norepinefrín.
Toto sa spočiatku používa enzýmom známym ako hydroxyláza tyrozín, ktorý je schopný pridať ďalšiu hydroxylovú skupinu do aromatického kruhu skupiny RI tyrozínu R, ktorá tvorí zlúčeninu známu ako DOPA.
DOPA vedie k dopamínu, akonáhle je enzymaticky spracovaný enzýmom DOPA Decboboxilas.
Dopamín sa následne premieňa na norprenalín pôsobením p -oxidázového dopamínového enzýmu, ktorý katalyzuje pridanie hydroxylovej skupiny do -ch, ktorá bola súčasťou skupiny R tyrozínu a ktorý fungoval ako „most“ medzi aromatickým krúžkom a uhlík α.
Adrenalín pochádza z norepinefrínu pôsobením fenytanolamínu N-metyltransferáza, ktorá je zodpovedná za prenos metylovej skupiny (-ch3) závislého od S-adenozylu-mémií (-ch3) do voľnej aminoskupiny norepinefrínu.
Potraviny bohaté na tyrozín
Ako je uvedené vyššie, tyrozín je nevyhnutnou „podmienečne“ aminokyselinou, pretože je syntetizovaný v ľudskom tele hydroxyláciou fenylalanínu, esenciálny aminokyselina.
Preto, ak príjem fenylalanínu pokrýva požiadavky tela, tyrozín nie je obmedzujúcim faktorom pre normálne fungovanie buniek. Tyrozín sa však získava aj z bielkovín, ktoré sa konzumujú dennými potravinami.
Niektoré štúdie uvádzajú, že minimálny denný príjem tyrozínu a fenylalanínu by mal byť medzi 25 a 30 mg na kilogram hmotnosti, takže priemerný človek by mal konzumovať viac alebo menej 875 mg tyrozínu za deň.
Potraviny s vyšším obsahom tyrozínu sú syr a sójové bôby. Medzi nimi patrí aj hovädzie, jahňacie, bravčové, kuracie mäso a ryby.
Niektoré semená a orechy, ako sú orechy.
Výhody vášho príjmu
Tyrozín sa bežne konzumuje vo forme výživových alebo výživových doplnkov, konkrétne na liečbu patológie známeho ako fenylcetonúria, utrpieť pacientmi, ktorí nie sú schopní správne spracovať fenylalanín, a preto neprodukujú tyrozín.
Môže vám slúžiť: Funkcia vzťahuPredpokladá sa, že zvýšenie množstva konzumovaného tyrozínu za deň môže zlepšiť kognitívne funkcie súvisiace s učením, pamäťou a výstražným stavom v stresových podmienkach, pretože jeho katabolizmus súvisí so syntézou adrenalínu a norepineniálnych neurotransmiterov.
Niektorí ľudia berú tablety bohaté na tirosín, aby zostali v strehu počas dňa, ak stratili značné množstvo spánkových hodín.
Keďže táto aminokyselina sa podieľa na tvorbe hormónu štítnej žľazy, jeho spotreba môže mať pozitívne účinky na systémovú metabolickú reguláciu.
Poruchy nedostatku
Albinizmus a alcaptonúria sú dve patológie súvisiace s metabolizmom tyrozínu. Prvá podmienka súvisí s defektnou syntézou melanínu z tyrozínu a druhá súvisí s defektmi degradácie tyrozínu.
Albinizmus sa vyznačuje nedostatkom pigmentácie v koži, to znamená, že pacienti, ktorí ju trpia, majú biele vlasy a ružovkastú pokožku, pretože melanín je pigment zodpovedný za poskytovanie farby týmto štruktúram.
Táto patológia súvisí s nedostatkom špecifickej tyrozinázy melanocytov, ktorá je zodpovedná za premenu tyrozínu na dopa-chinón, sprostredkovateľ v syntéze melanínu.
Príznaky alcaptonúrie sú zrejmé ako prehnaná pigmentácia moču (tmavá) a artritída neskorého vývoja.
Ostatné metabolické patológie
Okrem toho existujú aj ďalšie poruchy súvisiace s metabolizmom tyrozínu, medzi ktoré patria:
- Dedičná tyrozinémia typu I: charakterizovaná progresívnou degeneráciou pečene a dysfunkciou obličiek
- Dedičná tyrozinémia syndrómu typu II alebo Richner-Hanhart: čo je zrejmé ako keratitída a ampulované lézie v dlaniach rúk a chodidiel
- Tyrosinémia typu III: ktorá môže byť asymptomatická alebo prítomná ako mentálne oneskorenia
- „Hawkinsinúria“: charakterizovaná metabolickou acidózou v detstve a neschopnosťou prosperovať v raste
Existujú aj ďalšie vrodené defekty v metabolizme metrozínu, ktoré súvisia s nedostatkami v enzýmoch zodpovedných za ich degradáciu, ako je hydroxyláza tyrozín, zodpovedá za prvý krok syntézy dopamínu z tyrozín.
Odkazy
- Aders Plimmer, R. (1908). Chemická ústava proteínov. odišiel som. Londýn, UK: Longmans, Green a Co.
- Chakrapani, a., Gissen, P., & McKiernan, P. (2012). Poruchy metabolizmu tyrozínu. V Vrodená metabolická túžba: diagnostika a liečba (PP. 265-276).
- Kretchmer, n., Levine, s., McNamara, h., & Barnett, h. (1956). Niektoré aspekty metabolizmu tyrozínu u mladých. Jo. Vývoj systému oxidácie tyrozínu v ľudskej pečeni. The Journal of Clinical Equesting, 35(10), 1089-1093.
- Du, b., Zannoni, v., Laster, L., & Seegmiller, e. (1958). Povaha defektu metabolizmu tyrozínu v alkaptonúrii. Journal of Biological Chemistry, 230, 251-260.
- Murray, r., Bender, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Harperova ilustrovaná biochémia (28. ED.). McGraw-Hill Medical.
- Nelson, D. L., & Cox, M. M. (2009). Lehninger princípy biochémie. Vydanie omega (5. vydanie.).
- Schenck, C. Do., & Maeda, h. Do. (2018). Biosyntéza tyrozínu, metabolizmus a katabolizmus v rastlinách. Fytochémia, 149, 82-102.
- Slominski, a., Zmijewski, m. Do., & Paweley, J. (2012). L-Tyrosín a L-dihydroxyfenylalanín ako hormónové regulátory funkcií melanocytov. Výskum pigmentových buniek a melanómu, 25(1), 14-27.
- Van de, g. (2018). Zdravotnícka línia. Získané 16. septembra 2019, od www.Zdravotná čiara.com
- MD Web. (n.d.). Získané 15. septembra 2019, od www.Webmd.com
- Whitbread, D. (2019). Moje údaje o potravinách. Získané 15. septembra 2019, od www.Myfooddata.com

