Druhy batérií, charakteristík a reakcií

- 3276
- 1024
- Ing. Ervín Petruška
Na trhu sa môžete líšiť Typy batérií s jej karakteristika vlastný. Batérie, ktoré nie sú ničím iným ako voltaické bunky, poskytujú spotrebiteľovi výhodu prijatého na akékoľvek miesto (za predpokladu, že podmienky nie sú drastické).
Všeobecne sa dajú kúpiť batérie izolované; Ale sú tiež pripevnení k sebe v sérii alebo paralelnom, ktorého set je to, čo nazývajú batérie. A tak niekedy sa výrazy „batérie“ a „batérie“ zvyčajne používajú bez rozdielu, aj keď nie sú rovnaké.
 Alkalické batérie: jeden z najznámejších typov batérií
Alkalické batérie: jeden z najznámejších typov batérií Batérie môžu mať nespočetné množstvo farieb, tvarov a veľkostí, ktoré môžu byť vyrobené z iných materiálov. A čo je dôležitejšie, ich vnútorná štruktúra, kde sa vyvíjajú chemické reakcie, ktoré vyvíjajú elektrinu, slúži na ich odlíšenie od seba od seba.
Napríklad tri alkalické batérie, jedna z najbežnejších je znázornená na hornom obrázku. Termín alkalická sa vzťahuje na skutočnosť, že médium, v ktorom sa uvoľňuje a tok elektrónov, je základné; to znamená, že má pH väčšie ako 7 a OH anióny prevládajú- a ďalšie negatívne poplatky.
[TOC]
Klasifikácia Pilas
Pred riešením niektorých rôznych typov batérií je potrebné vedieť, že sú klasifikované globálne ako primárne alebo sekundárne.
- Primárne batérie
Primárne batérie sú tie, ktoré po konzumácii musia byť vyradené alebo recyklované, pretože chemická reakcia, na ktorej je elektrický prúd udržiavaný, je nezvratná. Preto sa nemožno nabíjať.
Používajú sa hlavne v aplikáciách, kde je nepraktické nabíjanie elektrickej energie; napríklad na vojenských zariadeniach, uprostred bojiska. Sú tiež určené pre vybavenie, ktoré spotrebúva malú energiu, takže vydržia dlhšie; Napríklad diaľkové ovládacie prvky alebo prenosné konzoly (Gameboy, Tetris a Tamagotchi).
Alkalické batérie, ktoré citujú ďalší príklad, tiež patria k primárnemu typu. Zvyčajne majú valcové formy, hoci to neznamená, že valcové batérie nemôžu byť sekundárne alebo nabíjateľné.
- Sekundárne batérie
Na rozdiel od primárnych batérií sa môžu sekundárne nabíjať, keď dôjdu energia.
Je to preto, že chemické reakcie, ktoré sa v nich vyskytujú v nich, sú reverzibilné, a preto po použití určitého napätia spôsobuje, že druh produktového druhu sa znova stane činidlom, aby znova začal reakciu.
Niektoré sekundárne batérie (nazývané batérie) sú zvyčajne malé, ako sú primárne; Sú však pridelené zariadeniam, ktoré spotrebúvajú viac energie a pre ktoré by bolo použitie primárnych batérií ekonomicky a energicky. Napríklad batérie mobilných telefónov obsahujú sekundárne batérie.
Sekundárne batérie sú tiež určené pre veľké vybavenie alebo obvody; Napríklad auto batérie, ktoré sa skladajú z niekoľkých batérií alebo voltaických buniek.
Zvyčajne sú drahšie ako primárne batérie a batérie, ale na dlhodobé použitie sú nakoniec vhodnejšou a efektívnejšou možnosťou.
- Ostatné aspekty
Batérie sú klasifikované buď v primárnom alebo sekundárnom; Ale komerčne alebo populárne sú zvyčajne klasifikované podľa formulára (valcovitá, obdĺžniková, tlačidlá), do zariadenia určené (kamery, vozidlá, kalkulačky), podľa ich mien (AA, AAA, C, D, N, A23 atď. .) A jeho kódy IEC a ANSI.
Môže vám slúžiť: pyridín: štruktúra, vlastnosti, použitie, toxicita, syntézaCharakteristiky, ako je jeho napätie (1,2 až 12 voltov), ako aj ich životnosť a ceny, sú zodpovedné za udelenie určitej klasifikácie v očiach spotrebiteľa.
Zoznam typov hromád
- Batérie uhlíka
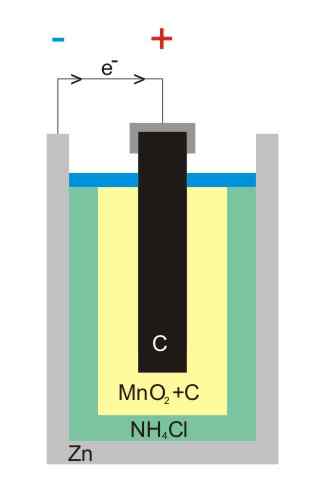 Ilustrácia batérie zink-uhlíka
Ilustrácia batérie zink-uhlíka Batérie uhlíka-zinok (známe tiež ako bunky Leclanché alebo Salinas Pilas) sú jednou z najprimitívnejších a v súčasnosti sa považujú za takmer nepoužívané pred ostatnými batériami; Najmä pred alkalickými batériami, ktoré sú hoci sú o niečo drahšie, majú životnosť a veľké napätie.
Ako už názov napovedá, jeho elektródy pozostávajú z plechovky zinku a grafitovej tyče, ktorá zodpovedá anóde a katóde.
V prvej elektróde anóda pochádza z elektrónov oxidáciou kovového zinku. Tieto elektróny potom prechádzajú vonkajším obvodom, ktorý napája zariadenie elektrinou a potom končí v grafitskej katóde, kde je cyklus dokončený, keď je oxid mangánu znížený, v ktorom je ponorený.
Reakcie
Chemické rovnice pre reakcie, ktoré sa vyskytujú v elektródach, sú:
Zn (s) → Zn2+(Ac) + 2e- (Anóda)
2 Mno2(s) + 2e- + 2 NH4Cl (ac) → Mn2Ani3(s) + 2 NH3(Ac) + h2Alebo (l) + 2 cl- (Ac) (katóda)
Tieto batérie sú veľmi podobné alkalickým: obe sú valcové (napríklad batérie obrázka). Avšak, batérie uhlíka-zinok je možné rozlíšiť, ak sa charakteristiky označené v zahraničí podrobne čítajú alebo ak vášmu kódu IEC predchádza písmeno R. Jeho napätie je 1,5 V.
- Alkalické batérie
Alkalické batérie sú veľmi podobné ako batérie typu uhlíka-zinku, s rozdielom, že médium, kde elektródy obsahujú OH anióny-. Toto médium pozostáva zo silných elektrolytov hydroxidu draselného, KOH, ktoré prispieva OH- zúčastňujú sa a „spolupracujú“ na migrácii elektrónov.
Dodáva sa v rôznych veľkostiach a napätí, hoci najbežnejšia je 1,5 V. Sú to možno najznámejšie batérie na trhu (napríklad Duracell).
Reakcie, ktoré sa vyskytujú v ich elektródach, sú:
Zn (s) + 2OH-(aq) → ZnO (s) + h2Alebo (l) + 2e- (Anóda)
2Mn2(s) + h2Alebo (l) + 2e- → Mn2Ani3(s) + 2OH-(aq) (katóda)
Keď sa teplota zvyšuje, reakcie sa vyskytujú rýchlejšie a rýchlejšie sa vypúšťajú batérie. Zaujímavé je, že populárne zvesti boli vyvolané, aby ich vložili do mrazničky, aby zvýšili svoj životný čas; Ale pri chladení môže jeho obsah utrpieť možné tuhnutia, ktoré s nimi prinášajú ďalšie chyby alebo riziká.
Ortuť
 Pravdepodobná ortuťová batéria, ktorú je možné zamieňať s batériou oxidu striebra. Zdroj: Multicherry [CC0].
Pravdepodobná ortuťová batéria, ktorú je možné zamieňať s batériou oxidu striebra. Zdroj: Multicherry [CC0]. Batérie ortuti sú veľmi charakteristické kvôli svojej zvláštnej hanbe strieborných tlačidiel (vynikajúci obraz). Takmer každý by ich na prvý pohľad rozpoznal. Sú tiež alkalické, ale ich katóda zahŕňa okrem grafitu a oxidu mangánu, oxidu ortuti, HGO; čo sa po znížení stáva kovovou ortuťou:
Zn (s) + 2OH-(Ac) → ZnO (s) + h2Alebo (l) + 2e-
HGO (s) + h2O + 2e- → Hg (s) + 2OH-
Môže vám slúžiť: oxid horečnatý: štruktúra, vlastnosti, nomenklatúra, použitiaVšimnite si, ako sa v týchto bunkových reakciách konzumujú a regenerujú OH anióny-.
Ako malé batérie sú určené pre malé artefakty, ako sú hodinky, kalkulačky, ovládacie prvky hračiek atď. Kto použil niektorý z týchto objektov, si všimne, že nie je potrebné meniť batérie na takmer „večnosť“; čo by malo mať 10 rokov, približne.
Oxid striebra
 Oxidové batérie. Zdroj: Lukas A, CZE [verejná doména].
Oxidové batérie. Zdroj: Lukas A, CZE [verejná doména]. Hlavnou poruchou ortuťových batérií je to, že keď sú vyradené, predstavujú pre životné prostredie vážny problém z dôvodu toxických charakteristík uvedeného kovu. Možno to chýba IEC a ANSI kódy chýbajú. V prípade batérií oxidu striebra predchádza jeho kód IEC písmeno S.
Jeden z náhradníkov za ortuťové batérie zodpovedá oxidu striebra, oveľa drahší, ale menej ekologického nárazu (vynikajúci obraz). Na začiatku obsahovali ortuť na ochranu zinku pred alkalickou koróziou.
Je k dispozícii s napätím 1,5 V a jeho aplikácie sú veľmi podobné aplikáciám Mercury Pila. V skutočnosti na prvý pohľad vyzerajú obe batérie rovnako; Aj keď môžu existovať oveľa väčšie batérie oxidu striebra.
Reakcie v ich elektródach sú:
Zn (s) + 2OH-(Ac) → Zn (OH)2(s) + 2 e-
Zápis2Alebo (s) + 2h+(Ac) + 2e- → 2AG (s) + h2Alebo (l)
Voda následne trpí elektrolýzou, rozkladá sa na H ióny+ a oh-.
Všimnite si, že namiesto ortuti sa tvorí v kovovej striebornej katóde.
- Nickel-Cadmium Pilas (Nicad)
 Batéria. Zdroj: Lordider [CC0].
Batéria. Zdroj: Lordider [CC0]. Z tohto bodu sa uvažujú o sekundárnych batériách alebo batériách. Rovnako ako ortuť, batérie nikel-kadmia sú škodlivé pre životné prostredie (pre faunu a zdravie) kovovým kovom.
Vyznačujú sa generovaním vysokých elektrických prúdov a môže sa nabíjať veľké množstvo. V skutočnosti je možné nabíjať 2000 -krát, čo sa rovná mimoriadnej trvanlivosti.
Jeho elektródy pozostávajú z hydroxidu oxidu niklu, dieťaťa (OH), pre katódu a kovového kadmia pre anódu. Chemická nadácia v podstate zostáva rovnaká: kadmium (namiesto zinku) stráca elektróny a Cadmium Nio (OH) ich vyhrá.
Semimecelované reakcie sú:
CD (S) + 2OH-(Ac) → CD (OH)2(s) + 2e-
2nio (OH) (s) + 2h2Alebo (l) + 2e- → 2NI (OH)2(s) + oh-(Ac)
Ach anióny-, Opäť pochádzajú z elektrolytu Koh. Nicad batérie, potom nakoniec vytvoríte hydroxidy niklu a kadmu kovu.
Používajú sa jednotlivo alebo sú spojené v balíkoch (napríklad žltý, vynikajúci obraz). Potom prídu vo veľkých alebo malých balíkoch. Najmenší nájdu použitie v hračkách; Ale tie veľké sú určené pre lietadlá a elektrické vozidlá.
- Nickel-Hydro Metallic Pilas (Ni-HM)
 Batérie ni-HM. Zdroj: Ramsh ng flickr (https: // www.Flickr.com/photos/Rameshng/5645036051)
Batérie ni-HM. Zdroj: Ramsh ng flickr (https: // www.Flickr.com/photos/Rameshng/5645036051) Ďalšou známym batériou alebo batériou, ktorá presahuje Nicad's v energetických kapacitách, je Ni-HM (nikel a kovový hydrid). Môže sa dodávať v valcovom formáte (konvenčné batérie, vynikajúci obraz) alebo spojený v batérii.
Chemicky prítomné takmer rovnaké vlastnosti ako NICAD batérie, s hlavným rozdielom založeným na jeho negatívnej elektróde: katóda nie je kadmium, ale intermetalickej zliatiny vzácnych zemín a prechodných kovov.
Môže vám slúžiť: Rotary Sušer: Prevádzka, pre čo je, časti, aplikácieTáto zliatina je zodpovedná za absorbovanie vodíka vytvoreného počas zaťaženia a vytvára komplexný kovový hydrid (odtiaľ písmeno H v jeho názve).
Zatiaľ čo batérie Ni-HM poskytujú viac energie (približne o 40% viac), sú drahšie, nosia rýchlejšie a nemožno ich načítať rovnaký počet ako NICAD batérie; to znamená, že majú nižšiu užitočnú životnosť. Chýba im však účinok pamäte (strata výkonu batérie tým, že nie sú úplne prepustení).
Z tohto dôvodu by sa nemali používať v strojových zariadeniach z dlhodobého hľadiska; Aj keď bol tento problém zabalený do batérií LSD-NIHM. Podobne, batérie alebo batérie NI-HM majú veľmi stabilné tepelné vlastnosti, ktoré sú prevádzkovateľné v širokom spektre teploty bez toho, aby predstavovali riziko.
Reakcie
Reakcie, ktoré sa vyskytujú v ich elektródach, sú:
Ni (oh)2(s)+ oh-(ac) ⇌ nio (OH) (s) + h2Alebo (l) + e-
H2Alebo (l) + m (s) + e- ⇌ Oh-(ac)+ mh (s)
- Batérie ion-litio
 Lítium-iónová batéria notebooku. Zdroj: Kristoferb z Wikipédie.
Lítium-iónová batéria notebooku. Zdroj: Kristoferb z Wikipédie. V batériách a lítiových batériách sú založené na migrácii iónov Li+, ktoré sa prenášajú z anódy do katódy, produkt elektrostatických odporov rastúcim kladným nábojom.
Niektoré sa môžu nabíjať, ako sú batérie prenosných počítačov (vynikajúci obraz) a iné, valcové a obdĺžnikové (hladké2, Lisokl2 alebo limuzína2) Nie.
Batérie ion-litio sa vyznačujú tým, že sú veľmi svetlom a energiou, čo im umožňuje používať v mnohých elektronických zariadeniach, ako sú smartfóny a zdravotnícke vybavenie. Sotva trpia pamäťovým efektom, hustota ich zaťaženia presahuje hustotu batérií a batérií NICAD a NI-HM a pri sťahovaní sa viac oneskorí.
Sú však veľmi citlivé na vysoké teploty, dokonca aj výbuch; A navyše sú zvyčajne drahšie pred ostatnými batériami. Napriek tomu sú na trhu lítiové batérie videné s dobrými očami a mnohí spotrebitelia ich kvalifikujú ako najlepší.
- Kyslé olovené batérie
 Typická batéria Carf Car batéria. Zdroj: Tntflash [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Typická batéria Carf Car batéria. Zdroj: Tntflash [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] A nakoniec, baktérie olovených kyselín, ako už názov napovedá, neobsahujú OH ióny- ale h+; konkrétne koncentrovaný roztok kyseliny sírovej. Voltaické bunky sú vo svojich škatuliach (horný obrázok), kde tri alebo šesť z nich môžu byť spojené v sérii, čo dáva batériu 6 alebo 12 V, respektíve.
Je schopný generovať veľké množstvo elektrického náboja, a pretože sú veľmi ťažké, sú určené na aplikácie alebo zariadenia, ktoré sa nedajú prepravovať ručne; Napríklad autá, solárne panely a ponorky. Táto kyslá batéria je najstaršia a stále je v platnosti v automobilovom priemysle.
Vaše elektródy sú vyrobené z olova: PBO2 Pre katód. Reakcie, ktoré sa v nich vyskytujú, sú:
PB (s) +HSO-4(aq) → PBSO4(s) +h+(aq) + 2e-
PBO2(s) +HSO-4(aq) + 3h+(aq) + 2e- → PBSO4(s) + 2h2Alebo (l)
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Odunlade Emmanuel. (24. júla 2018). Rôzne typy batérií a uvaľovania. Obvod. Obnovené z: CircuitDigest.com
- Prba. (s.F.). Typy batérií. Získané z: PrBA.orgán
- Isidor Buchman. (2019). Aká je najlepšia batéria? Univerzita. Zdroj: BatteryUniversity.com
- Spoločnosti McGraw-Hill. (2007). Kapitola 12: Batérie. [PDF]. Získané z: Oakton.Edu
- Shapley Patricia. (2012). Bežné typy batérií. University of Illinois. Zotavené z: bután.Chem.Priekopa.Edu
- Ekologický postoj. (22. januára 2017). Typy batérií: Kompletný sprievodca s batériami a batériami, ktoré existujú. Zdroj: Ekkologické.com
- « Biografia Tomás Mejía, vojenská kariéra, streľba
- Kyslé anhydridy, ako sa tvoria, aplikácie a príklady »

