Kyslé anhydridy, ako sa tvoria, aplikácie a príklady

- 1180
- 247
- Denis Škriniar
Ten kyslé anhydridy Sa považujú za veľký význam medzi širokou škálou zlúčenín organického pôvodu, ktoré existujú. Sú prezentované ako molekuly, ktoré majú dve kyslé skupiny (organické substituenty, ktorých vzorec je RCO-, kde r je uhlíkový reťazec) spojené s rovnakým atómom kyslíka.
Existuje tiež trieda kyslých anhydridov, ktorá sa bežne nachádza: karboxylové anhydridy, nazývané preto, že počiatočná kyselina je kyselina karboxylová. Aby sme vymenovali tých typu, ktorého štruktúra je symetrická, je potrebné vykonať iba výmenu pojmov.

Kyslá expresia sa musí nahradiť v nomenklatúre svojej pôvodnej karboxylovej kyseliny pomocou anhydridu, čo znamená „bez vody“, bez zmeny zvyšku názvu vytvorenej molekuly. Tieto zlúčeniny sa môžu tiež generovať na základe jednej alebo dvoch kyslých skupín z iných organických kyselín, ako je kyselina fosfónová alebo kyselina sulfónová.
Podobne môžu byť kyslé anhydridy spôsobené na základe kyseliny anorganovej, ako je kyselina fosforečná. Jeho fyzikálne a chemické vlastnosti, jeho aplikácie a ďalšie charakteristiky závisia od vykonanej syntézy a štruktúry anhydridu.
[TOC]
Ako sa tvoria kyslé anhydridy?
Niektoré kyslé anhydridy pochádzajú z rôznych spôsobov, či už v laboratóriu alebo v priemysle. V priemyselnej syntéze sa ako príklad berie anhydrid octovej.
Ďalším príkladom tejto syntézy je syntéza anhydridu maleico, ktorý sa vytvára oxidáciou molekuly benzénu alebo butánu.
Môže vám slúžiť: zinkový hydroxid (Zn (OH) 2)Avšak pri syntéze kyslých anihydridov v laboratóriu sa kladie dôraz na dehydratáciu zodpovedajúcich kyselín, ako je napríklad produkcia etanického anhydridu, v ktorom sa dehydratujú dve molekuly kyseliny etaovej, aby sa zvýšili spomínané zlúčeniny.
Môže sa vyskytnúť aj intramolekulárna dehydratácia; To znamená v rámci tej istej molekuly kyseliny s dvoma karboxylovými (alebo dikarboxylovými) skupinami, ale ak dôjde k opakovaniu a anhydrid kyseliny trpí hydrolýzou, dochádza.
Kyslé anhydridy, ktorých acylové substituenty sú rovnaké, zatiaľ čo v anhydridoch tohto typu sa považujú za zmiešané tieto molekuly sa líšia.
Tieto druhy sa však generujú aj vtedy, keď dôjde k reakcii medzi kyslým halur (ktorého všeobecný vzorec je (rcox)) s molekulami karboxylátu (ktorej všeobecným vzorcom je r'Cooo-))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))) )skýálny. [2]
Všeobecný vzorec
Všeobecný vzorec kyslých anhydridov je (RC (O))2Alebo, čo je lepšie pozorované na obrázku umiestnenom na začiatku tohto článku.
Napríklad pre anhydrid octického (z kyseliny octovej) je všeobecný vzorec (ch3Co)2Alebo písanie podobne pre mnoho ďalších podobných kyslých anhydridov.
Ako je uvedené vyššie, tieto zlúčeniny majú takmer rovnaké meno svojich prekurzorových kyselín a jediná vec, ktorá sa mení.
Žiadosti
Kyslé anhydridy majú veľa funkcií alebo aplikácií v závislosti od oblasti, ktoré sa študuje, pretože majú vysokú reaktivitu, môžu byť prekurzorovými činidlami alebo byť súčasťou mnohých dôležitých reakcií.
Môže vám slúžiť: pyrolýzaPríkladom toho je priemysel, v ktorom sa anhydrid octov vyrába vo veľkých množstvách, pretože je to najjednoduchšia štruktúra, ktorá sa dá izolovať. Táto anhydrid sa používa ako dôležité organické činidlo, ako sú estery acetátu.
Priemyselné použitie
Na druhej strane je anhydrid maleico znázornený s cyklickou štruktúrou, ktorá sa používa pri výrobe pokrytia na priemyselné použitie a ako prekurzor niektorých živíc prostredníctvom procesu kopolymeterizácie s molekulami Stretus molekuly Stretus. Okrem toho táto látka slúži ako dienofil, keď sa vykonáva reakcia Diels-Alder.
Podobne existujú zlúčeniny, ktoré majú vo svojej štruktúre dve molekuly kyslých anhydridov, ako je etystarboxylový alebo diahydrid dianhydrid.
Okrem toho existuje zmiešaný anhydrid nazývaný 3'-fosfoadenosín-5'-fosfosulfát, z kyselín fosforu a kyseliny sírovej, ktorý predstavuje najbežnejší koenzým v reakciách prenosu sulfátových sulfátov.
Príklady kyslých anhydridov
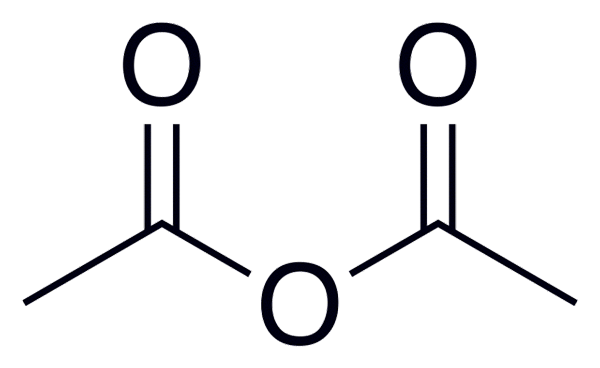 Anhydrid octov
Anhydrid octov Nižšie je uvedený zoznam s názvami niektorých kyslých anhydridov, ktorý uvádza niektoré príklady týchto dôležitých zlúčenín v organickej chémii, ktoré môžu tvoriť zlúčeniny lineárnej štruktúry alebo krúžkov niekoľkých členov:
- Anhydrid octov.
- Anhydrid propany.
- Benzoický anhydrid.
- Anhydrid maleico.
- Sukcinický anhydrid.
- Fthalický anhydrid.
- Naftalente -Trakarboxylický diahydrid.
- Etytertarboxylový diahydrid.
- Benzokchinonterarboxylický dianhydrid.
Rovnako ako sa tvoria tieto anhydridy s kyslíkom, sú uvedené aj ďalšie zlúčeniny, kde sa atóm síry nahradí kyslík v karbonylovej skupine a centrálnom kyslíku, napríklad: napríklad:
Môže vám slúžiť: acetanylid (C8H9No)- Tioatický anhydrid (vyberte3C (s)2Buď)
Existuje dokonca prípad dvoch kyslých molekúl, ktoré tvoria spojenie s rovnakým atómom síry; Tieto zlúčeniny sa volajú Tioanhydridy, menovite:
- Acetický tioanhydrid ((ch3Co))2S)
Odkazy
- Wikipedia. (2017). Wikipedia. Získaný z.Wikipedia.orgán
- Johnson, a. W. (1999). Pozvanie do organickej chémie. Zotavené z kníh.Riadenie.co.ísť.
- Acton, Q. Do. (2011). Hydrolas anhydridu kyseliny: Pokroky vo výskume a aplikácii. Zotavené z kníh.Riadenie.co.ísť
- Bruckner, R., A Harmata, m. (2010). Organické mechanizmy: reakcie, stereochémia a syntéza. Zotavené z kníh.Riadenie.co.ísť
- Kim, J. H., Gibb, h. J., a Iannucci,. (2009). Anhydridy kyseliny cyklovej: Aspekty ľudského zdravia. Zotavené z kníh.Riadenie.co.ísť

