Farbenie spór
- 4553
- 2
- MUDr. Žigmund Boška
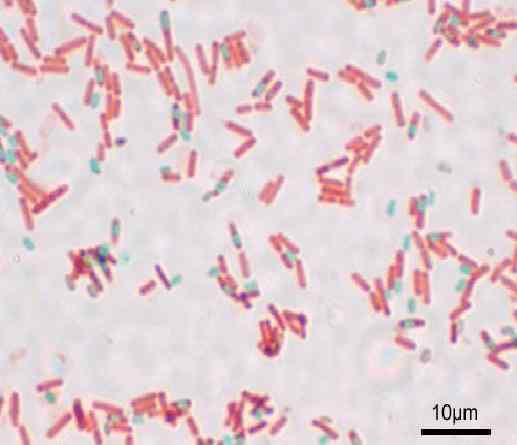
 Farbenie spór metódou Shaeffer-Fulton alebo Wirtz-Conklin. Zdroj: y tiež (originálny Uploader) [GFDL (http: // www.GNU.Org/copyleft/fdl.HTML) alebo CC-BE-SA-3.0, Wikimedia Commons
Farbenie spór metódou Shaeffer-Fulton alebo Wirtz-Conklin. Zdroj: y tiež (originálny Uploader) [GFDL (http: // www.GNU.Org/copyleft/fdl.HTML) alebo CC-BE-SA-3.0, Wikimedia Commons Aké je zafarbenie spór?
Ten Farbenie spór Je to metodika použitá na zafarbenie rezistentných štruktúr, ktoré tvoria niektoré bakteriálne rody, keď sú v nepriaznivých podmienkach. Slúži na identifikáciu baktérií.
Existuje veľa žánrov, ktoré tvoria spóry, ale hlavné sú Bacil a Clostridium. Tieto žánre sa považujú za relevantnejšie, pretože majú patogénne druhy pre človeka.
Každý bacil môže viesť k spórovaniu. V čase farbenia prípravy je možné nájsť spór vo vnútri Bacillus (endospora) alebo mimo tohto (exospora). S konvenčnými sfarbeniami pre baktérie - napríklad farbenie gramov - spóry sú bezfarebné.
V súčasnosti existuje niekoľko metodík sfarbenia, ktoré sú schopné prekročiť silnú štruktúru spór, aby ju farbali. Tieto metodiky sú veľmi rozmanité a Dornerova technika, Möellerovo farbenie a metodika Shaeffer-Fulton, je možné spomenúť aj ako Wirtz-Conklin.
Zo všetkých uvedených techník je metodika Shaeffer-Fulton najpoužívanejšia v rutinných laboratóriách. Dlhuje svoj názov dvom mikrobiológom, ktorí vytvorili sfarbenie v roku 1930: Alicia Shaeffer a MacDonald Fulton. Niekedy sa však táto technika nazýva Wirtz-Conklin na počesť dvoch 1900 bakteriológov.
Základ
Spóry nie sú zafarbené konvenčnými sfarbeniami, pretože majú veľmi hrubú stenu. Komplexné zloženie spór bráni vstupu väčšiny farbív.
Ak je vonkajšia spór, ktorá sa študuje dovnútra, pozorujú sa nasledujúce vrstvy: po prvé, existuje exosporium, ktoré je najlepšou a naj vonkajšou vrstvou tvorenou glykoproteínmi.
Potom prichádza kutikula, ktorá poskytuje odolnosť proti vysokým teplotám, po ktorej nasleduje kôra zložená z peptidoglykánu. Následne existuje základňa základne, ktorá chráni protoplast.
Spór je dehydratovaná štruktúra, ktorá obsahuje 15% vápnikovej a dipycolínovej kyseliny. Preto je väčšina spór sfarbenie techník založená na aplikácii tepla, aby farbivo preniklo do hrubej štruktúry.
Môže vám slúžiť: laktogenéza: Charakteristiky a etapyAkonáhle je spór zafarbený, nemôže vylúčiť farbivo. V technike Shaeffer-Fulton vstupuje Malachit's Green do vegetatívnych buniek a pomocou tepla prenikne do endospora.
Pri umývaní vodou sa farbivo odstráni z vegetatívnej bunky. K tomu dochádza, pretože zelené farbivo Malachitu je mierne základné, takže vegetatívna bunka sa slabo viaže.
Namiesto toho sa nemôžete dostať zo spór a nakoniec je najatý Bacillus s Safranine. Táto nadácia je platná pre zvyšky techník, v ktorých sa niečo podobné stáva.
Spóry sfarbenie techník
Ak chcete vykonať farbenie spór, musíte mať čistú plodinu podozrivého kmeňa, ktorú chcete študovať.
Plodina je podrobená extrémnym teplotám počas 24 hodín, aby sa mikroorganizmus stimuloval sporulárny. Za týmto účelom môže byť plodina umiestnená do 44 ° C alebo v chladničke (8 ° C) počas 24 alebo 48 hodín.
Ak necháte príliš dlho pri vyššie uvedených teplotách, budú pozorovaní iba exosparáti, pretože všetci endospori opustia Bacillus.
Vyvrcholil čas, malo by sa umiestniť niekoľko kvapiek sterilného fyziologického roztoku na čistom posúvaní. Potom sa odoberie malá časť plodiny a predĺžená pokuta.
Následne sa nechá vyschnúť, je pripevnená do tepla a farbiva s niektorými technikami vysvetlenými nižšie:
Technika Dorner
- Pripravte sa v skúmavke Koncentrovaná suspenzia mikroorganizmu sporulovaného v destilovanej vode a pridajte rovnaký objem Fenicada Fuchsina z Kinyoun filtrovaného filtrovaného.
- Vložte trubicu do kúpeľa s vriacou vodou medzi 5 a 10 minútami.
- Na čistom posúvaní zmiešané kvapky predchádzajúcej suspenzie s kvapkou vodného roztoku nigrosínu pri 10%, varené a filtrované.
- Roztiahnite a vysušte mäkkou teplom.
- Preskúmajte so 100x cieľom (ponorenie).
Spóry sú zafarbené červené a bakteriálne bunky sa javia takmer bezfarebné na tmavo šedom pozadí.
Môže vám slúžiť: Helmintológia: pôvod, aké štúdie, príklad výskumuUpravená technika Dorner
- Rozšírená jedna z suspenzie sporulovaného mikroorganizmu sa vyrába na posúvaní a pripevnená na zahrievanie.
- Vzorka je pokrytá pruhom filtračného papiera, ku ktorému sa pridá Fenicada fuchsin. Farbivo sa zahrieva 5 až 7 minút s plameňom zapaľovača Bunsen, kým sa nevytvorí odlúčenie pary. Potom je papier stiahnutý.
- Príprava s vodou sa premyje a potom vyschne absorpčným papierom.
- Rozmach je pokrytý tenkým filmom 10%nigrosínu, pomocou druhého sklíčka na predĺženie nigrosínu alebo ihly.
Zafarbenie spór a baktérie sa rovná farbe opísaným v predchádzajúcej technike.
Technika Shaeffer-Fulton alebo Wirtz-Conklin
- Urobte predĺženú pokutu so suspenziou sporulovaného mikroorganizmu na posúvaní a opravte teplotu.
- Zakryte sklíčko vodným zeleným roztokom malachitu pri 5% (na plachte je možné umiestniť filtračný papier).
- Zahrievajte na plameň Bunsen's Zapaľovač, až kým nespôsobí odlúčenie pár a neodstráni plameň. Opakujte operáciu 6 až 10 minút. Ak sa počas procedúry vypaľuje malachitovo zelená roztok, je možné pridať viac.
- Odstráňte filtračný papier (ak je umiestnený) a premyjte vodou.
- Zakryte sklíčko 0,5% vodného safranínu po dobu 30 sekúnd (niektoré varianty techniky používajú 0,1% vodného safranínu a nechajte ho 3 minúty).
S touto technikou sú spóry prezentované zelené a červené bacily.
Má nepríjemnosti, že endospory mladých plodín nie sú dobre zafarbené, pretože vyzerajú veľmi jasne alebo bezfarebne. Aby sa tomu zabránilo, odporúča sa použiť 48 -hodinové inkubačné plodiny.
Technika Möellera
- Zakryte rozmazanie chloroformom 2 minúty.
- Zlikvidovať chloroform.
- Pokryte 5% kyselinou chromovou po dobu 5 minút.
- Umyť destilovanou vodou.
- List s fuchsin-fenicadským karbolom je zakrytý a vystavený plameňu Bunsena zapaľovača až do emisie výparov, potom sa odstráni z plameňa o pár okamihov. Operácia sa opakuje do 10 minút.
- Umyť vodou.
- Na zafarbenie alkoholu použite okyslený etanol (hydrochlorický alkohol). Zostane na 20 alebo 30 sekúnd.
- Umyť destilovanou vodou.
- Prenájom pokrývajúceho plachty metylénovou modrou po dobu 5 minút.
- Umyť destilovanou vodou.
- Nechá sa vyschnúť a odobrať vzorku do mikroskopu.
Spóry vyzerajú červené a modré bacily. Je dôležité, aby ste sa nesnažili o výpary, pretože sú toxické a dlhodobé, môžu byť karcinogénne.
Möellerová technika modifikovaná bez tepla
V roku 2007 Hayama a jeho spolupracovníci vytvorili modifikáciu Möellerovej techniky. Eliminovali sfarbenie farbiva a nahradili ho pridaním 2 kvapiek povrchovo aktívnej látky tergitolu 7 pre každých 10 ml roztoku karbolového fuchsínu-fenikovaného karbol. Rovnaké výsledky sa získali.
Žiadosti
Zafarbenie spór poskytuje veľmi cenné a užitočné informácie na identifikáciu patogénu, pretože prítomnosť toho istého, jeho tvar, umiestnenie v bacili a schopnosť deformovať vegetatívnu bunku alebo nie, sú údaje, ktoré môžu tento druh viesť Druh zapojený do určitého pohlavia.
V tejto súvislosti sa oplatí povedať, že spóry môžu byť okrúhle alebo oválne, môžu byť umiestnené v strede alebo tiež v palacentrálnej, podskupinovej alebo terminálovej polohe.
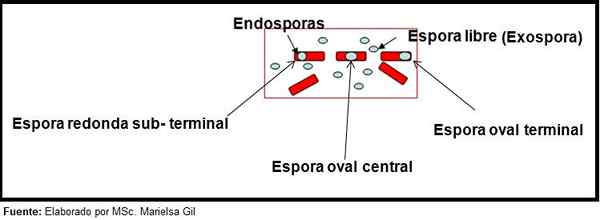 Schéma formy a polohy endosporov a exospore
Schéma formy a polohy endosporov a exospore Príklady
- Clostridium difficile Tvorí oválna spór v terminálovej polohe, ktorá deformuje Bacillus.
- Spór Clostridium Tercium Je oválny, nezdraví bacil a je umiestnený na úrovni terminálu.
- Endospora Clostridium tetani Je to terminál a deformuje bacil, čo dáva vzhľad bubnovej tyčinky.
- Spóry Clostridium botulorium, C. histolyticum, C. Nováčik a C. septicum Sú okrúhle alebo oválne, podzemné a deformujú Bacillus.
- Endospora Clostridium Sordelli Nachádza sa v centrálnej polohe s miernou deformáciou.
Odkazy
- Zafarbenie. Získaný z.Wikipedia.orgán.
- Endospora. Zotavené z es.Wikipedia.orgán.
- Forbes, b., SAHM, D., Weissfeld, a. Mikrobiologická diagnostika Bailey a Scott. PAN -AMERICKÁ REDICIAL S.Do.

