Kmeňová tabuľka
- 2427
- 97
- Mgr. Pravoslav Mokroš
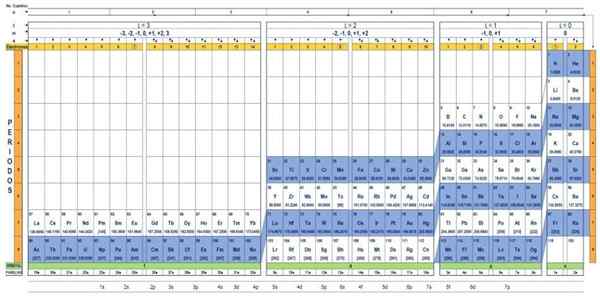
 Kvantová tabuľka prvkov. Zdroj: UNAM.
Kvantová tabuľka prvkov. Zdroj: UNAM. Aká je kvantová tabuľka?
Ten Kmeňová tabuľka Je to spôsob, ako usporiadať chemické prvky, navrhnuté na ľahké určenie množiny kvantových čísel, ktoré charakterizujú každú z nich.
Vedci zistili, že v povahe všetkých prvkov existujú určité vzory. Medzi tieto vzory patria kvantové čísla, štyri jednoduché čísla, ktoré opisujú elektronickú konfiguráciu každého prvku.
Kvantové čísla vznikajú prirodzene z mechanického mechanického modelu atómu a sú označené písmenami: n, ℓ, mℓ a s. Opisujú energetický stav elektrónov v atóme každého chemického prvku.
Prostredníctvom tradičnej periodickej tabuľky a niektorých ďalších nástrojov je možné mať elektronickú konfiguráciu atómu akéhokoľvek prvku. Výhodou kvantovej tabuľky je, že prvky sú usporiadané tak, aby boli okamžite viditeľné ich kvantové čísla, bez toho, aby bolo potrebné robiť početné výpočty osobitne.
Charakteristiky kvantovej tabuľky
Existuje niekoľko vzorov kvantových tabuliek. Model znázornený na obrázku vyššie obsahuje:
- Hlavička so štyrmi radmi, s hodnotami štyroch kvantových čísel, n, ℓ, ma s plus piaty riadok v žltej farbe, čo zodpovedá počtu elektrónov vo vonkajšej orbitáli.
- Telo tabuľky, ktorá pozostáva z mriežky, ktorá obsahuje symbol chemického prvku, počínajúc vodíkom, v predposlednom stĺpci vpravo, po ktorom nasleduje hélium atď. Nižšie uvedené číslo predstavuje množstvo atómových elektrónov v základnom stave.
- V spodnej časti, v zelenom rade sú štyri triedy, ktoré organizujú prvky: orbitály S, P, D a F (zľava doprava).
- Nakoniec je pod orbitálnym radom rodina. Každý stĺpec je rodina, očíslovaná od 1 do 32. Napríklad 1. a 2. rodiny patria do triedy S, rodiny od 3. do 8a, patria do triedy P atď.
Čo je kvantová tabuľka pre?
Kvantová tabuľka slúži na nájdenie množiny kvantových čísel, ktoré charakterizujú elektrón z atómu. Normálne budú tieto elektróny elektróny z najvzdialenejšej vrstvy, pretože sú to tie, ktoré definujú chemické správanie prvku.
Aká je kvantová tabuľka?
Kvantová tabuľka umožňuje ľahko nájsť kvantové čísla elektrónov vo vonkajšej vrstve atómu.
Príklad 1
Na ilustráciu postupu sa hliníkový prvok považuje za príklad, ktorého symbolom je pre. Prvým krokom je lokalizácia v kvantovej tabuľke a označiť ho s a Červená kruh:
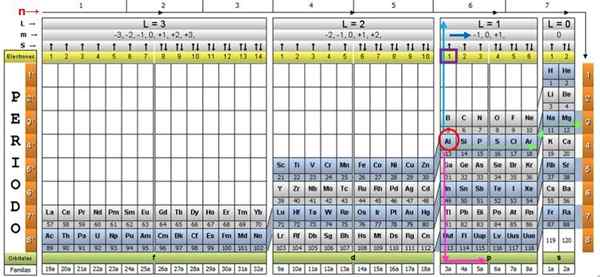
Krok 1: Nájdite n
Po nájdení prvku v tabuľke sa musíte pohybovať cez rovnaký riadok a farbu doprava, až kým nedosiahnete oranžový stĺpec, po ceste zelenej šípky zobrazenej na obrázku.
Šípka ukazuje na označené políčko s číslom 3, čo je hlavné kvantové číslo n:
n = 3
Krok 2: Nájdite ℓ
Na stanovenie sekundárneho kvantového čísla sa dodržiava modrá vertikálna šípka, ktorá naznačuje:
ℓ = 1.
Krok 3: Nájdite m
Vonkajší hliníkový elektrón sa nachádza v rodine pubillingu P, ako je možné čítať v zelenom riadku, do ktorého body ružovej šípky bodujú.
Okrem toho sa množstvo elektrónov v poslednej vrstve prečíta v žltom riadku hlavičky. V prípade hliníka je 1 elektrón (zvýraznený na fialovom štvorci), čo je referencia. Kombináciou vyššie uvedených výsledkov je konfigurácia poslednej vrstvy:
Môže vám slúžiť: galvanická bunka: časti, ako funguje, aplikácie, príklady3p1
Je známe, že vrstva P podporuje maximálne 6 elektrónov. A číslo m berie niektoré z celých hodnôt - ℓ, ( - ℓ+1),… 0,… (+−1),+ℓ.
Ako v tomto prípade ℓ = 1, potom M môže byť −1, 0, 1.
Tieto čísla sa objavujú v riadku hlavičky zodpovedajúcej M (pozri na obrázku Horizontálna šípka Modrá). Nasledujúca tabuľka slúži ako sprievodca, aby zistil, aká je hodnota výberu, v závislosti od prípadu:
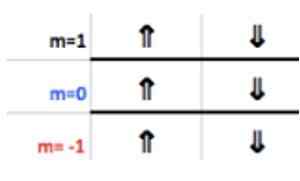
Pretože posledná hliníková vrstva má 1 elektrón, magnetické kvantové číslo zodpovedá
m = 1.
Krok 4: Nájdite siež
Číslo rotácie má iba dve hodnoty: +½ alebo - ½. V hornom políčku, ak šípka označuje, je vybraná s = +½ a ak nasmeruje dole, potom s = - ½. V prípade hliníka, elektrón 1 body, preto:
S = + ½.
Stručne povedané, kvantové čísla elektrónu najvzdialenejšej vrstvy hliníka k zvuku:
n = 3; ℓ = 1; M = 1, s = +½
Príklad 2 (výnimočné prípady)
Silver AG a asi dvadsať ďalších prvkov sú výnimočné prípady, takže pri používaní kvantovej tabuľky sa musí venovať starostlivosť.
Ak sa opakuje predchádzajúci postup, AG by sa získal ako posledná úroveň na 4D9.
Je to preto, že predpovedaná konfigurácia La Plata, podľa Madelungovho pravidla, je:
1s2 2s2 2 P6 3s2 3p6 4s2 3D10 4p6 5s2 4d9
V praxi však AG neinstuľuje túto konfiguráciu presne, ani žiadne iné prvky, ktorých posledná predpovedaná vrstva je 4D9, napríklad meď a zlato, okrem iného (poraďte sa na internete a získajte úplný zoznam prvkov, ktoré nedodržiavajú pravidlo Madelungu).
Môže vám slúžiť: MeloalitySkutočná konfigurácia AG je:
1s2 2s2 2 P6 3s2 3p6 4s2 3D10 4p6 5s1 4d10
V ktorom elektrón vrstvy 5S2 skočil do 4D vrstvy9 na dokončenie. Týmto spôsobom sa zvyšuje stabilita atómu. Preto posledná čiastková úroveň je skutočne:
5s1
A jeho kvantové čísla by boli čísla zodpovedajúce prvku RB, zobrazené vo fialovej škatuli, s pomarančovými šípkami smerujúcimi na zostávajúce čísla:
n = 5; ℓ = 0; m = 0; S = +½
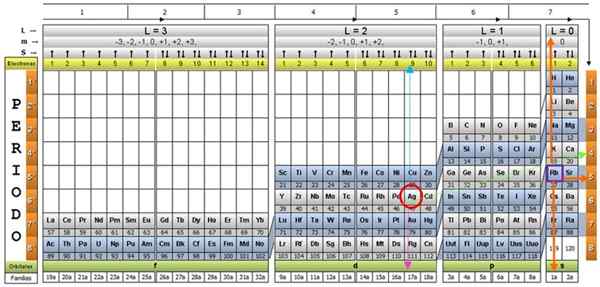 Preskúmanie periodickej tabuľky, v skutočnosti je zrejmé, že AG je v období 5, charakteristika stanovená hlavným kvantovým číslom n.
Preskúmanie periodickej tabuľky, v skutočnosti je zrejmé, že AG je v období 5, charakteristika stanovená hlavným kvantovým číslom n.
Rozdiely s periodickou tabuľkou
Obe tabuľky sú dva spôsoby, ako usporiadať chemické prvky podľa charakteristík ich atómov:
-V periodickej tabuľke majú prvky nachádzajúce sa v rovnakom stĺpci podobné chemické vlastnosti. Napríklad začína stĺpom alkalických kovov vľavo a končí stĺpom ušľachtilých plynov doprava. Zatiaľ čo v radoch sú prvky s rovnakou vyššou úrovňou energie.
-Kvantová tabuľka má stupňové dispozície navrhnuté podľa pravidiel vyplňovania. Preto musíte postupovať podľa krokov na získanie hlavného kvantového čísla, s výnimkou prípadu výnimiek, ako je striebro, v príklade predchádzajúcej časti. Rodiny prvkov v tejto tabuľke sú spojené cez hornú dráhu, v S, P, D alebo F.
Odkazy
- Chang, R. 2013. Chémia. 11 VA. Vydanie. McGraw Hill Education.
- Elektronická konfigurácia. Elektronická konfigurácia a kvantové čísla. Zdroj: ConfiguionectronicA.com.
- Chemická príručka. Zdroj: DCB.inžinierstvo.Žobrák.mx.
- Oficiálna chémia. Ako ľahké kvantové čísla ľahké. Zdroj: Oficiálny chémia.com
- Trojica. Výnimky z pravidla Madelungu v elektronickej konfigurácii chemických prvkov. Zdroj: Triplenlace.com.

