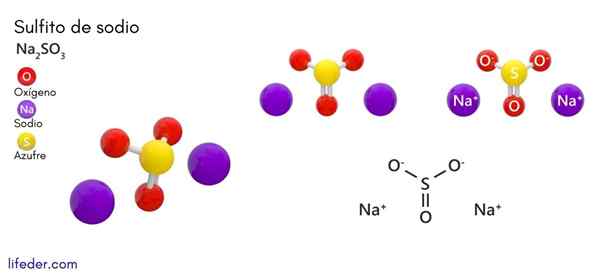
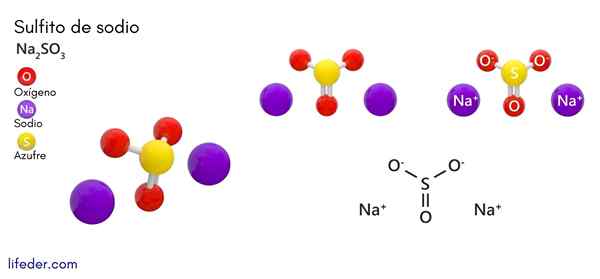
Sulfit sodný (Na2SO3)
- 2602
- 420
- MUDr. Miloslav Habšuda
Čo je sodný sulfit?
On sodný alebo sulfit sodný, ktorého chemický vzorec je NA2SW3, Je to rozpustná sodná soľ, ktorá sa získa ako produkt reakcie kyseliny sírovej (alebo oxidu síry (IV)) s hydroxidom sodným.
V rokoch 1650 až 1660 začal Glauber vyrábať sírany sodný z bežnej soli (NaCl) a koncentrovanej kyseliny sírovej. Tento proces sa považuje za začiatok chemického priemyslu.
Processulfitový proces vytvára drevú buničinu, ktorá sa pozoruje ako takmer čistá celulózová vláknina pomocou niekoľkých solí kyseliny sírovej na extrahovanie lignínu drevených štiepok.
Síranty teda majú veľké množstvo aplikácií rôznych typov, a to aj v potravinárskom priemysle ako prísady. Medzi jeho najdôležitejšie funkcie, enzymatické a neinzymatické hnednutie, kontrola a inhibícia mikrobiálneho rastu, prevencia oxidačného zakorenenia a modifikácia reologických vlastností potravín.
Prípravok sodný
Všeobecne platí, že v laboratórnom stupnici sa sulfit sodný vyskytuje pri reakcii roztoku hydroxidu sodného s plynným oxidom siričitého (2NaOH + SO2 → NA2SW3 + H2Buď).
Potom vývoj SO2 Pridaním niekoľkých kvapiek koncentrovanej kyseliny chlorovodíkovej sa naznačuje, či hydroxid sodný takmer chýba, zmení sa na vodný síran sodný (NA2SW3 + 2HCl → 2NACL + SO2 + H2Buď).
Na druhej strane, táto chemická zlúčenina sa získava priemyselne reagovaním oxidu sulfidu s roztokom uhličitanu sodným sodným.
Môže vám slúžiť: spektrálny zápisPočiatočná kombinácia generuje bisulfit sodný (Nahso3), Že reakciou s hydroxidom sodným alebo karoxidom sodným sa premieňa na síran sodný. Tieto reakcie možno zhrnúť v globálnej reakcii2 + Nat2Co3 → NA2SW3 + Co2.
Chemická štruktúra
Všetky tvary síranu sodného sa vyznačujú tým, že sú biele, kryštalické a hygroskopické tuhé látky, ktoré majú schopnosť ľahko priťahovať a udržiavať molekuly vody v okolitom prostredí, ktoré sú normálne pri izbovej teplote.
Typ kryštalickej štruktúry je spojený s prítomnosťou vody v zlúčenine. Sulfit sodného sodného predstavuje orcombickú alebo hexagonálnu štruktúru a v prípade, že v zlúčenine je prítomnosť molekúl vody, mení jej štruktúru (napríklad heptahydrate sulfit sodný predstavuje monoklinickú štruktúru).
Vlastnosti
Tento druh má určité fyzikálne a chemické vlastnosti, ktoré ho odlišujú od iných solí, ktoré sú opísané nižšie:
Chemické vlastnosti
Ako nasýtený vodný roztok má táto látka približné pH 9. Okrem toho roztoky vystavené vzduchu nakoniec oxidujú síran sodný.
Na druhej strane, ak sa síulka sodného vodného roztoku nechá kryštalizovať pri teplote miestnosti alebo nižšou, robí to ako hepthydrát. Heptahydrats Crystals EnfloreSce v horúcom a suchom vzduchu, tiež oxidujú vo vzduchu, aby vytvorili sulfát.
V tomto zmysle je forma anhydry oveľa stabilnejšia proti oxidácii vzduchu. Sulfit je nezlučiteľný s kyselinami, silnými oxidantmi a vysokými teplotami. Je tiež nerozpustný v amoniaku a chlóru.
Môže vám slúžiť: izopropylalkoholFyzikálne vlastnosti
Sulfit sodného sodného má molárnu hmotnosť 126,43 g/mol, hustotu 2 633 g/cm3, Fúzny bod 33,4 ° C (92,1 ° F alebo 306,5 K), bod varu 1 429 ° C (2 604 ° F alebo 1 702 K) a nie je horľavý. Rozpustnosť (meraná pri teplote 20 ° C) je tiež 13,9 g/100 ml.
Použitie/aplikácie
Vďaka svojim reaktívnym vlastnostiam je sulfit sodný veľmi univerzálny a v súčasnosti používa široko typy odvetví.
- Sa široko používa na úpravu vody a elimináciu rozpusteného kyslíka vo vodných kotlach.
- Má tiež aplikácie v papierovom priemysle (polo -kidová buničina).
- Vo fotografii sa používa pri výrobe odhalenia.
- Vo vhodnom stupni sa používa na ochranu potravín a antioxidantov.
- V textilnom priemysle sa používa v praní a procesoch anticloro.
- Používa sa tiež ako redukčné činidlo.
- Okrem toho sa používa pri sekundárnom regenerácii olejových vrtov.
- Používa sa dokonca na výrobu organických zlúčenín, farbív, atramentov, viskózneho rayónu a gumov.
- Používa sa na výrobu mnohých chemikálií, vrátane síranu draselného, síranu sodného, kremičitanu sodného, hyposulfitu sodného a síranu hlinitý sodný.
Riziká
Účinky na vystavenie zlúčenine
Predĺžené alebo opakované vystavenie tejto látke môže spôsobiť reakcie dermatitídy a citlivosti. Expozícia v sulfite citlivých, astmatických a atopických.
Podobne môže kyslý rozklad síranu sodného uvoľňovať toxický a nebezpečný dym oxidov síry vrátane oxidu siričitého, ktorý môže spôsobiť trvalé zhoršenie pľúc v dôsledku chronickej a akútnej expozície.
Môže vám slúžiť: Ididio 192Podobne je akútna otravu oxidom siričitého zriedkavý, pretože sa ľahko zistí plyn. Je to tak dráždivé, že kontakt nemožno tolerovať.
Medzi príznaky, kašeľ, povesti, kýchanie, trhanie a dýchanie sú zahrnuté. Zamestnanci s vysokou nevyhnutnou expozíciou však môžu utrpieť dôležité a prípadne smrteľné poškodenie pľúc.
Ekotoxicita
Sulfit sodný je nehazardózny roztok, ktorý sa bežne používa ako zvyškové činidlo poklesu vody. Vysoké koncentrácie prispievajú k vysokému dopytu po chemickom kyslíku vo vodnom prostredí.
Konzumácia potravín s konzervačnými látkami
Jedným z prísad, ktoré môžu spôsobiť problémy s citlivými ľuďmi, je skupina známa ako sulfitačné činidlá, ktoré zahŕňajú niekoľko sulfitových anorganických prísad (E220-228), vrátane síranu sodného (takže2).
U hypersenzitívnych alebo astmatických ľudí, konzumácia potravín so sulfitmi alebo vdýchnutie oxidu siričitého, môže byť toxická.
Tieto zlúčeniny sú zodpovedné za bronch-obmedzenia, ktoré sa premieta do dýchacích problémov. Jedinou liečbou tejto nadmernej reakcie je vyhnúť sa potravinám a nápojom obsahujúcim sulfit.