Štruktúra mangánového síranu (MNSO4), vlastnosti, získanie, použitie, použitie

- 4315
- 978
- Valentín Dula
On mangánový síran (II) Je to anorganická tuhá látka tvorená mangánskymi prvkami (Mn), síry (S) a kyslík (O). Jeho chemický vzorec je MSO4. Jeho bezvodý tvar (bez vody v jej štruktúre) je biela pevná látka. Má však niekoľko hydratovaných foriem a všetky sú ružové pevné látky.
Mangánový síran vo veľmi malých (malých) množstvách sa používa ako mikroživina pre zvieratá aj pre ľudí, pretože je potrebný na normálne fungovanie organizmu.
 Mangán sulfát anhidro Mnso4. YOSF0113 v angličtine Wikipedia / Public Domain. Zdroj: Wikimedia Commons.
Mangán sulfát anhidro Mnso4. YOSF0113 v angličtine Wikipedia / Public Domain. Zdroj: Wikimedia Commons. Pridá sa tiež spolu s určitými hnojivami v nedostatočných pôdach v mangáne (MN) pre poľnohospodárske plodiny, ktoré to potrebujú, ako sú napríklad hroznové rastliny.
Kvôli ružovému sfarbeniu jej hydratovaných odrôd sa používa v pigmentoch, ktoré slúžia na maľovanie keramiky, sfarbenie tkanín a iných materiálov. Slúži tiež na získanie ďalších zlúčenín mangánu.
Mons4 Musí byť starostlivo manipulovaný. Jeho vdýchnutie môže spôsobiť problémy s dýchacími cestami a spôsobiť vážne nepríjemnosti v nervovom systéme, ktoré zahŕňajú príznaky podobné Parkinsonovej chorobe.
Jeho prebytok môže tiež spôsobiť poškodenie pôdy a vodných zvierat a rastlín.
[TOC]
Štruktúra
Sírant bezvodého mangánu (bez vody vo svojej kryštalickej štruktúre) je tvorený mangánskym iónom v oxidácii +2, to znamená Mn2+ a anión sulfátu42-.
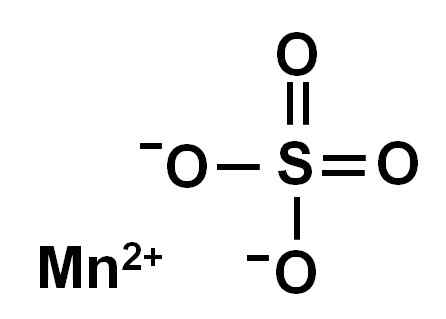 Chemická štruktúra síranu mangánu4. Autor: Marilú Stea.
Chemická štruktúra síranu mangánu4. Autor: Marilú Stea. Menovanie
- Mangánový síran (II)
- Mangánový monosulfát
- Mangán sulfát anhidro Mnso4
- Mangánový mangán sulfát MSSO4 •H2Ani
- Tetrahydrate mangán sulfát MSO4 •4H2Ani
- Pentahydrát sulfátu mangánu4 •5H2Ani
- Sulfát mangánu4 •7h2Ani
Vlastnosti
Fyzický stav
Mons4 bezvodý (bez vody v jej štruktúre) je kryštalická biela tuhá látka. Hydratované odrody sú však ružové alebo svetlo červené tuhé látky.
 Manganeso sulfát tetrahydrát MNSO4.4H2Alebo je ružová pevná látka. Benjah-Bmm27 / verejná doména. Zdroj: Wikimedia Commons.
Manganeso sulfát tetrahydrát MNSO4.4H2Alebo je ružová pevná látka. Benjah-Bmm27 / verejná doména. Zdroj: Wikimedia Commons. Molekulová hmotnosť
MSSO4 = 151 g/mol
MSSO4 •H2O = 169,02 g/mol
Bod topenia
Bezvodý4 = 700 ° C
Monohydrát MSO4 •H2O = 400-450 ° C
Mokra4 •4H2O = 30 ° C
Bod varu
Bezvodý4 = Rozkladá sa pri 850 ° C.
Môže vám slúžiť: chlorid kobaltu (COCL2 (: štruktúra, nomenklatúra, vlastnostiMokra4 •4H2O = 850 ° C
Hustota
MSSO4 = 3,25 g/cm3
MSSO4 •H2O = 2,95 g/cm3
Rozpustnosť
Veľmi rozpustné vo vode: 52 g/100 ml vody pri 5 ° C. Rozpustný alkohol. Nerozpustný v éteri. Mierne rozpustný v metanole.
pH
Monse Riešenie4 •H2Alebo 5% má pH 3,7.
Chemické vlastnosti
Pri rozpustení vo vode je MNSO4 rozdelený na svoje ióny MN2+ A tak42-.
Mangánový ión (ii) Mn2+ V kyslom alebo neutrálnom roztoku je spojený s 6 molekulami vody2Alebo formovanie hexaacuomanganského iónu [MN (h (h2Buď)6]2+, Čo je ružové.
Hexaacuomanganský ión [MN (H2Buď)6]2+ Je celkom odolný voči oxidácii. V základnom médiu (alkalické pH) sa tento ión stáva manganovým hydroxidom (II) Mn (OH)2, ktoré sa ľahko oxidujú a tvoria zlúčeniny mangánu (III) a mangán (IV).
 Riešenia MSSO4 Kyseliny sú ružové prítomnosťou hexaacuomanganského iónu [Mn (H (H (H2Buď)6]2+. Autor: Steve Cross. Zdroj: Pixabay.Mangánový síran má niekoľko hydratovaných foriem, to znamená s vodou h2Alebo vo svojej kryštalickej štruktúre.
Riešenia MSSO4 Kyseliny sú ružové prítomnosťou hexaacuomanganského iónu [Mn (H (H (H2Buď)6]2+. Autor: Steve Cross. Zdroj: Pixabay.Mangánový síran má niekoľko hydratovaných foriem, to znamená s vodou h2Alebo vo svojej kryštalickej štruktúre.
Toto sú monohydrát MSO4 •H2Alebo tetrahydrát MSO4 •4H2Alebo MNSE pentahydrát4 •5H2O a hepthydrát MSO4 •7h2Ani. Tieto hydratované formy obsahujú hexaacuomanganský ión [MN (h (h (h (h2Buď)6]2+ Vo svojich kryštáloch az tohto dôvodu sú to ružové pevné látky.
Monohydrátové menso4 •H2Alebo je mierne výtvarná, čo znamená, že pri vystavení životnému prostrediu stráca časť svojej hydratačnej vody pomaly, keď je vystavená životnému prostrediu.
Získanie
Mons4 je možné získať ošetrením oxidu mangánu (II) MNO, MN manghanous Hydroxid (OH)2 o Mangánové uhličitan (II) MNCO3 S kyselinou sírovou H2SW4.
Mnco3 + H2SW4 → MSSO4 + H2Alebo + co2
Žiadosti
Ako výživový doplnok
Mangánový síran v malom množstve slúži určitým funkciám ľudského tela a zvierat.
Preto je dôležitá ako užitočná zlúčenina vo výžive a dodáva sa ako doplnok potravín. Používa sa v stopách (extrémne malé množstvá).
Vysoké množstvá môžu byť veľmi toxické a škodlivé.
Vo veterinárnej medicíne
Mons4 Podávajú sa kučeravé vtáky (kurčatá, morky, kačice a phaisány), aby sa zabránilo nedostatku alebo nedostatku prvku mangánu u týchto zvierat.
Môže vám slúžiť: jodát draselný (Kio3)V nich sa prejavuje nedostatok mangánu, napríklad ako choroba nazývaná peróza, ktorá je deformáciou kostí mladých vtákov.
 Patitos môže vyžadovať stopy Monste4 Vo svojej strave na zabránenie perózy. Autori: s. Hermann & F. Bohatstvo. Zdroj: Pixabay.
Patitos môže vyžadovať stopy Monste4 Vo svojej strave na zabránenie perózy. Autori: s. Hermann & F. Bohatstvo. Zdroj: Pixabay. Vzťahuje sa na kŕmenie týchto vtákov vo veľmi malých množstvách alebo stopách.
V poľnohospodárstve
Mangánové síran sa používa ako mikroživina v hnojivách pre vinič (hroznové rastliny) a tabakové plantáže v nedostatočných rebríkoch v mangáne.
Niektoré štúdie však naznačujú, že nadbytok síranu mangánu môže inhibovať alebo znížiť tvorbu určitých dôležitých enzýmov pre rast rastlín a ich ohnísk.
 V niektorých prípadoch sa uplatňuje Mnso4 do zeme, kde sú rastliny hrozna. Autor: Schwoaze. Zdroj: Pixabay.
V niektorých prípadoch sa uplatňuje Mnso4 do zeme, kde sú rastliny hrozna. Autor: Schwoaze. Zdroj: Pixabay. Napríklad sa zistilo, že je toxický pre niektoré plodiny, ako je bavlna.
Mons4 Používa tiež na fungicídy a spolu s určitými organickými zlúčeninami sú súčasťou určitých pesticídov.
V niekoľkých aplikáciách
Mons4 Hydratovaný používa jeho sfarbenie na prípravu anorganických pigmentov, ktoré sa používajú v červených laku na keramiku, v tkaninách a iných materiálových farbách.
Mangánový síran sa používa vo výrobe skla a mydlá sa tiež pripravujú.
 Niektoré keramické dlaždice môžu obsahovať pigmenty síranu mangánu. Autor: Dwilliams. Zdroj: Pixabay.
Niektoré keramické dlaždice môžu obsahovať pigmenty síranu mangánu. Autor: Dwilliams. Zdroj: Pixabay. Mons4 Je to východiskový materiál na získanie elektrolyticky mangánového kovu (Mn), to znamená, že sa elektrina aplikuje na vodné roztoky.
Umožňuje vám tiež získať oxid mangánu2 a mangánový uhličitan3.
Mons4 Používa sa tiež na chemickú analýzu a pri formulácii roztokov používaných v genetických experimentoch s mikroorganizmami.
Riziká
Mangánový síran obsahuje mangánový ión (II) (MN2+), ktoré môžu byť neškodné aj toxické v závislosti od množstiev, na ktoré je vystavená osoba, zviera alebo rastlina.
Mangán je nevyhnutný pre normálne fungovanie organizmu ľudí, zvierat a niektorých rastlín. Ale bohužiaľ mangán je tiež neurotoxický, to znamená, že ovplyvňuje nervový systém a niektoré funkcie rastlín.
Môže vám slúžiť: kto navrhol prvý moderný teplomer?Zdanlivo bezpečné množstvá
Mons4 Podávané s potravinami v tvare potravín (extrémne malé alebo malé množstvá) je vo všeobecnosti bezpečné podľa správy potravín a liekov alebo FDA (skratka pre angličtinu Úrad pre potraviny a liečivá).
Nebezpečné sumy
Predĺžené alebo opakované vystavenie tejto zlúčenine v značných množstvách môže spôsobiť škodu človeku a zvieratám.
Vyvoláva podráždenie v slizniciach a slizniciach respiračného traktu, anorexie, bolesti hlavy, straty rovnováhy, pneumónie a respiračné infekcie.
Chronické vdychovanie spôsobuje poškodenie nervového systému, vytvára manganizmus, chvenie v typických rukách a príznaky Parkinsonovej choroby.
 Mangánový síran ovplyvňuje nervový systém. Autor: Sabine Zierer. Zdroj: Pixabay.
Mangánový síran ovplyvňuje nervový systém. Autor: Sabine Zierer. Zdroj: Pixabay. Preto by sa malo vyhnúť disperzii prachu MSO4, Používajte dýchacie vybavenie a ochranné rukavice.
Je toxický pre vodný život a v tom vytvára dlhodobé účinky. Musí sa uložiť na miestach, kde nie je prístup k odtoku alebo kanalizačnému systému. Je veľmi dôležité, aby sa nedovolilo, aby bol v životnom prostredí vyradený.
Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Mangán sulfátu. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Ullmannova encyklopédia priemyselnej chémie. (1990). Piaty vydanie. Zväzok A22. VCH Verlagsgellschaft MBH.
- Alebo.Siež. Lekárska knižnica. (2019). Monohydrát síranu mangánu. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Dunham, m.J. (2010). Sprievodca genetikou YAST: Funkčná genomika, proteomika a ďalšie systémy Analýza. Médium. V metódach v enzymológii. Zotavené z vedeckých pracovníkov.com.
- Saric, m. a Lucchini, r. (2007). Mangán. Používaš. V príručke o toxikológii kovov (tretie vydanie). Zotavené z vedeckých pracovníkov.com.
- Vallero, D. (2014). Neurologické účinky vzduchových oblíc. Mangán. Vo fondoch znečistenia ovzdušia (piate vydanie). Zotavené z vedeckých pracovníkov.com.
- Chee, r. (1986). In vitro Kultúra Vitis: Účinky síranu mangánu ľahkého spektra a jodidu draselného na morfogenézu. Plant Cell, TISS a Organ Cult 7: 121-134 (1986). Odkaz obnovený.Prubár.com.
- « Štruktúra secbutil, charakteristiky, nomenklatúra, školenie
- +125 Krátke a populárne výroky [s významom] »

