Síran železa (FESO4) Čo je, štruktúra, vlastnosti, syntéza
- 3545
- 953
- Gabriel Bahna
Čo je sulfát železa?
On Sulfát železa Je to anorganická soľ, ktorej chemický vzorec je feso4. Skladá sa z kryštalickej tuhej látky s variabilnou farbou, ktorá je priemyselne získaná ako sekundárny produkt spracovania ocele.
Nachádza sa v prírode v rôznych formách, najbežnejšou je heptohydratovaný sulfát železného, FESO4· 7h2O („Vitriolo Verde“, prítomný na melenterite minerále). Tento hydrát sa ľahko rozlišuje modrou zelenou farbou jeho kryštálov. Ostatné hydráty sú zvyčajne feso4· Xh2Alebo, kde x sa pohybuje od 1 do 7.
Heptahydrátový železný sulfát stráca molekuly vody v dôsledku zahrievania a môže sa transformovať do iných foriem síranu železného; Keď sa teda zahrieva 57 ° C, stráca tri molekuly vody a transformuje sa na železný tetrahydrát sulfát. Koľko celkovo môžete stratiť? Sedem molekúl vody, to znamená príliš veľa vody.
Sulfát železa sa používa pri liečbe a prevencii anémie nedostatku železa. Môže to však mať toxické účinky, takže vo svojej dávke musíte byť opatrní.
Štruktúra sulfátu železa
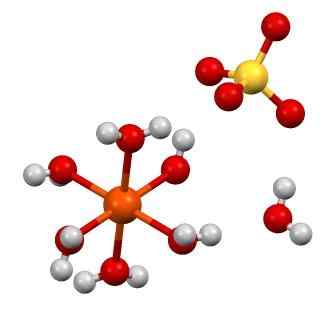
 Štruktúra FESO4 · 7H2O. Zdroj: Smokefoot [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Štruktúra FESO4 · 7H2O. Zdroj: Smokefoot [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Feso chemický vzorec4 Zdôrazňuje, že táto soľ sa skladá z viery iónov2+ A tak42- V pomere 1: 1. Oba ióny interagujú prostredníctvom elektrostatických síl takým spôsobom, že sú objednané v orlombickom kryštalickom systéme; ktorá logicky zodpovedá bezdrstovej soli.
Na hornom obrázku je na druhej strane zobrazená štruktúra FESO4· 7h2Ani. Oranžová guľa predstavuje katión viery2+, Čo sa oceňuje, súradnice so šiestimi molekulami vody za vzniku oktaedronu. Bremeno viery2+ priťahuje anión42-, A to zase, ak je to pozorované, tvorí vodíkový most s molekulami siedmej vody.
Siedma molekula vody (tá, ktorá je vzdialená od oktaedronu), tiež tvorí ďalší vodíkový most s ďalšou molekulou vody patriacou k susednému oktaedronu. Výsledkom týchto interakcií je to, že sklo prechádza z ortorrombického na monoklinický.
Ako kryštály FESO4 bezvodé hydratujú, anióny42- okolo viery2+ Sú nahradené molekulami H2Ani. Tieto substitúcie narušujú elektróny d železa, núti ich cestovať rôznymi úrovňami energie; ktoré sú zodpovedné za zmeny sfarbenia medzi bielymi, modrými zelenými.
Môže vám slúžiť: Sulfit sodný (Na2SO3)Fyzikálne a chemické vlastnosti
Mená
Žrôt sulfát alebo síran železa (II)
Molekulárna receptúra
-Ferroso anhydro sulfát (feso4)
-Heptahydrate Ferrous Sulfát (Feso4.7h2Buď)
Molekulová hmotnosť
Mení sa s stupňom hydratácie síranu. Napríklad síran železa hepthydrátu má molekulovú hmotnosť 278,02 g/mol; Zatiaľ čo anhydro má molekulovú hmotnosť 151,91 g/mol.
Fyzický vzhľad
Menia sa tiež s stupňom hydratácie. Napríklad bezvodá forma predstavuje orcombické biele kryštály; Kým vo forme Heptahidra, kryštály sú modro-zelené monokliniky.
Vôňa
Záchod
Hustota
Sulfát so železným ASHIDRO je najhustejší tvar soli (3,65 g/cm3). Na druhej strane forma heptahydrátu je najmenej hustá (1 895 g/cm3).
Bod topenia
Podobne sa to líši v závislosti od stupňa hydratácie. Tvar anhydry má bod fúzie 680 ° C (1.856 ° F, 973 K) a forma heptahydrátu, 60-64 ° C (140-147 ° F, 333-337 K).
Rozpustnosť
-Monohydrata forma: 44,69 g/100 ml vody (77 ° C)
-Heptahydrátová forma 51,35 g/100 ml vody (54 ° C).
Rozpustnosť
Nerozpustný.
Tlak vodnej pary
1,95 kPa (forma heptahydrátu)
Index lomu
1 591 (Monohydrata) a 1 471 (Heptahidrata).
Stabilita
Vo vzduchu môže rýchlo oxidovať a zakryté žltohnedou farbou, čo naznačuje prítomnosť katiónu viery3+. Oxidačná rýchlosť sa zvyšuje pridaním alkálie alebo vystavením svetlu.
Rozklad
Keď sa zahrieva na rozklad emituje toxický oxid siričitého a trioxid siričitý, pričom ako zvyšok zostane červenkastý oxid železa.
Reakcie
Je to redukčné činidlo, ktoré pôsobí na kyselinu dusičnú redukciou na oxid dusíka. Podobne redukuje chlór na chlorid a toxické formy formy prítomné v cemente s chrómom (III), s menšou toxicitou.
Syntéza
Z oceľovej vlny
Žrôtový síran sa vyrába reakciou ocele (viera) s kyselinou sírovou. Pri opísanej metóde sa dodržiava nasledujúci postup: oceľ sa používa v tvare oceľovej vlny, ktorá je predtým nešťastná s acetónom.
Môže vám slúžiť: chlorid železitý (FECL2): Štruktúra, použitie, vlastnostiPotom sa oceľová vlna umiestni v sklenenej kadičke a je úplne zakrytá kyselinou 30-40 %kyseliny sírovej, čo umožňuje trávenie kyseliny vyskytovať niekoľko hodín; Kým oceľová vlna nezmizne. Je možné pridať viac oceľovej vlny a opakovať postup niekoľkokrát.
Zelené kryštály, ktoré sa mohli tvoriť, sa redizolujú pomocou vodnej vody 1-2 s kyselinou sírovou. Tento roztok sa filtruje na filtračnom papieri a pH je upravené pridaním uhličitanu sodného. Roztok sa uloží, aby sa predišlo kontaktu s kyslíkom, a tak znevýhodňuje oxidáciu viery2+ k viere3+
Následne je filtrovanie vystavené odparovaniu pri teplote medzi 80-90 ° C. Tento postup sa vykonáva v kapsulách Pietri umiestnených na vykurovacej doske. Potom sa zhromažďujú vytvorené zelené kryštály, ktoré môžu byť odvezené do vysušovača na dokončenie dehydratácie.
Z pyritu
Vyrába sa aj sulfát železita na oxidáciu pyritu (FES2).
2 fes2 + 7 o2 + 2 h2O => 2 feso4 + 2 h2SW4
Riziká
Vdýchnutie feso4 spôsobuje podráždenie nosa, hrdlo a pľúca. Ak máte fyzický kontakt s touto soľou, môžete spôsobiť podráždenie pokožky a očí; Okrem toho môže predĺžený kontakt s nimi spôsobiť hnedasté miesto a poškodenie očí.
Opakovaný príjem môže spôsobiť nevoľnosť, zvracanie, bolesť žalúdka, zápcha a nepravidelné črevné pohyby.
Medzi príznakmi otravy síranu železého patrí: čierne alebo krvavé výkaly; modrú koža a nechty; zmeny objemu vylučovaného moču; mdloby; orálne suché alebo oči; prsná bolesť; jesť; Dýchacie ťažkosti.
Okrem toho sa môžu vyskytnúť rýchle a nepravidelné rytmy, zvýšenie smädu a hladu, nezvyčajná bledosť a skrátenie dýchania.
Zmena koagulácie je indikáciou otravy s železitým sulfátom, pozorovanie predĺženia trombínu, protrombínu a času tromboplastínu.
Štúdie o vplyve železného síranu na izolované svaly srdca králikov nám umožnili pozorovať, že spôsobuje zníženie maximálneho napätia vyvinutého študovanými srdcovými svalmi, ako aj maximálnu rýchlosť vývoja napätia.
Môže vám slúžiť: Vzťah chémie a technológie s človekom, zdravím a životným prostredímŽiadosti
V poľnohospodárstve
-Používa sa ako pesticíd na kontrolu štipky pšenice a rozklad ovocných stromov.
-Používa sa pri liečbe chlorózy, ochorenia, ktoré sa vyznačuje žltkastým farbou listov, spôsobenou alkalitou pôdy.
-Sulfát železa riadi zásadijnosť a znižuje pH pôdy.
- Eliminuje machu a podmienku trávni.
Ako činidlo av priemysle
V rámci použitia feso4 Ako činidlo av priemysle sú tieto:
-Analytické činidlo
-Surová hmota na získanie feritu a magnetického oxidu železa
-Zložka na vypracovanie anorganického modrého pigmentu
-Kyselina dusičná reaktívna, chlór a chróm
-Pri výrobe iných síranov
-Používa sa v galvanoplastických kúpeľoch so železom
-Drevený
-V hliníkovom leptaní
-Kvalitatívna analýza dusičnanov (hnedý žltý test pomocou oxidácie viery2+)
-Polymerizačný katalyzátor
-Používa sa ako predchodca syntézy iných žehličiek
-Používa sa priemyselne ako fixačný farbivo
-Pri výrobe farbiva na železo
-Mordant vo vlnovom zafarbení
-Dať striebornú farbu do Arce Wood
-Iron katalyzátor v Fentonovej reakcii
V medicíne a na opevnenie potravín
Používa sa pri liečbe anémie nedostatku železa s použitím dávky 150-300 mg železného síranu, trikrát denne, čo spôsobuje zjavné zvýšenie koncentrácie hemoglobínu v týždni liečby.
Jeho použitie u tehotných žien ako doplnku ich stravy sa tiež odporúča. Žrôtový síran sa používa ako astringent pri hojení rany hovädzieho dobytka.
Ďalší
Používa sa pri liečbe odpadovej vody flokuláciou a tiež na elimináciu fosfátu z týchto vôd. Na identifikáciu typov húb sa používa sulfát železného hepthydrátu.
Odkazy
- Príprava laboratória železného síranu. Obnovené z: crscientific.com
- Hepsulfát sulfát. Získané z: pubchem.Ncbi.NLM.NIH.Vláda

